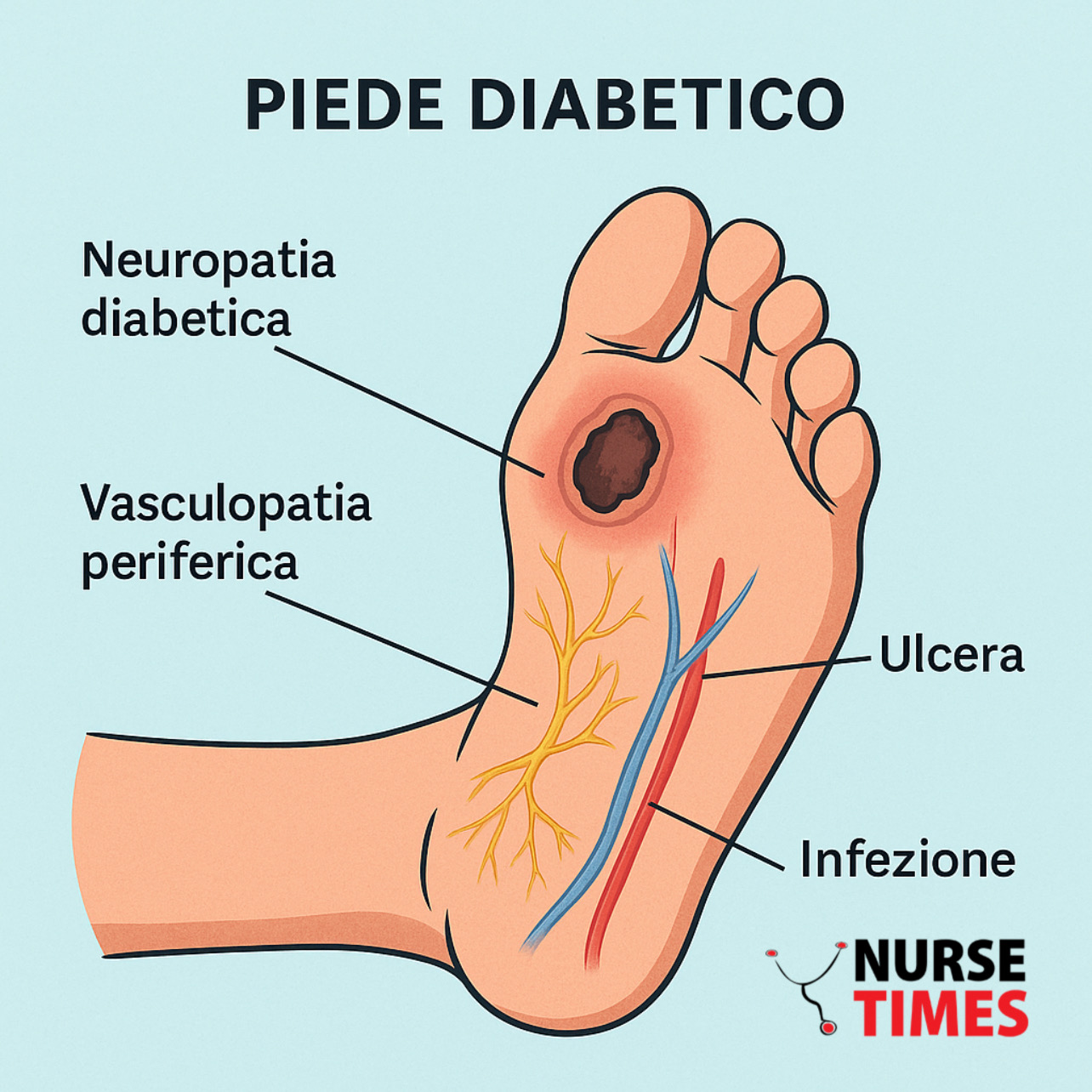
Il piede diabetico è una complicanza multifattoriale del diabete caratterizzata da neuropatia periferica, vasculopatia e alterazioni del microambiente cutaneo, che conduce a ulcere difficili da guarire e, nei casi più gravi, all’amputazione. La prevenzione si basa su screening periodici del rischio, esame clinico del piede e interventi educativi rivolti al paziente. Il trattamento richiede un approccio multidisciplinare: off‐loading, debridement, medicazioni avanzate (incluso l’uso di saccarosio‐octasolfato), terapia antibiotica mirata, correzione della perfusione arteriosa e controllo glicemico ottimale. Le innovazioni includono metodiche di rivascolarizzazione endovascolare, terapia a pressione negativa e uso di fattori di crescita.
1. Introduzione ed epidemiologia
Il piede diabetico rappresenta una delle complicanze più gravi e costose del diabete mellito, con un impatto significativo sia sulla qualità di vita dei pazienti sia sui sistemi sanitari. Si definisce piede diabetico qualsiasi infezione, ulcerazione o distruzione dei tessuti profondi del piede associata a neuropatia e/o arteriopatia periferica nei pazienti affetti da diabete.
Secondo l’International Working Group on the Diabetic Foot (IWGDF), circa il 15–25% delle persone con diabete svilupperà un’ulcera del piede nel corso della vita. Studi epidemiologici mostrano che:
- L’incidenza annuale di nuove ulcere è compresa tra il 2% e il 6%.
- Il 40% dei pazienti con una precedente ulcera va incontro a recidiva entro un anno dalla guarigione.
- Il rischio di amputazione maggiore (sopra o sotto il ginocchio) nei pazienti con ulcere del piede diabetico può arrivare fino al 20% a 5 anni.
- Il tasso di mortalità a 5 anni dopo un’ulcera o un’amputazione è comparabile o superiore a quello di molti tumori maligni, superando il 50%.
Dal punto di vista dei costi, si stima che la gestione delle complicanze del piede diabetico assorba fino al 20% delle risorse sanitarie destinate ai pazienti diabetici, considerando ospedalizzazioni, interventi chirurgici, terapie avanzate e riabilitazione.
Le principali cause epidemiologiche che favoriscono lo sviluppo del piede diabetico sono:
- Durata del diabete (>10 anni)
- Controllo glicemico subottimale (HbA1c elevata)
- Presenza di neuropatia periferica
- Malattia arteriosa periferica concomitante
- Deformità del piede (es. alluce valgo, dita a martello)
- Precedenti ulcere o amputazioni
Fattori di rischio aggiuntivi includono il fumo, l’insufficienza renale cronica, l’obesità e la scarsa consapevolezza da parte dei pazienti sui principi di cura del piede.
Tabella 1 – Prevalenza del piede diabetico per fasce d’età
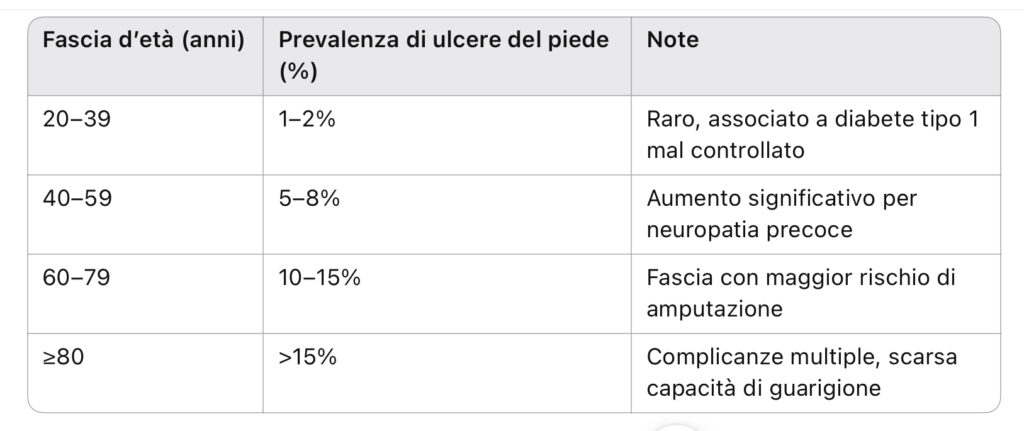
Fonte: IWGDF Guidelines 2023; ADA Standards of Care 2025.
Tabella 2 – Mortalità a 5 anni comparata
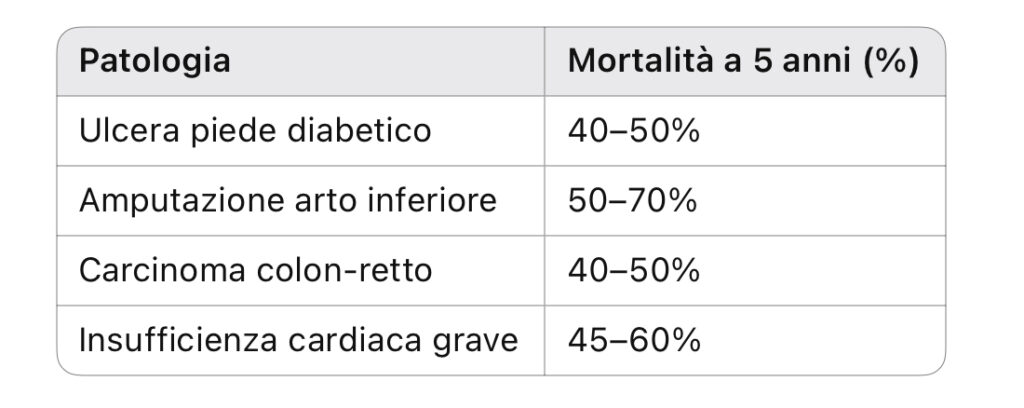
Fonte: Armstrong et al., Diabetes Care 2024; American Heart Association Reports 2024.
Box – Curiosità clinica
Un paziente diabetico che ha avuto un’ulcera al piede ha il doppio del rischio di morte rispetto a un paziente diabetico senza ulcere, indipendentemente dall’età, dal sesso e dal controllo glicemico.
2. Patogenesi
Il piede diabetico è il risultato di un’interazione complessa tra diversi fattori patologici, principalmente la neuropatia diabetica e la malattia vascolare periferica, aggravata da traumi minori e infezioni.
Neuropatia diabetica
La neuropatia periferica è il fattore patogenetico predominante nello sviluppo del piede diabetico. Coinvolge:
- Neuropatia sensitiva: riduzione o perdita della percezione del dolore, della temperatura e della pressione. I pazienti non avvertono traumi, ulcerazioni o callosità, che peggiorano senza trattamento.
- Neuropatia motoria: atrofia dei piccoli muscoli plantari, che porta a deformità come dita a martello, prominenze ossee, alterazioni della biomeccanica del piede e aumento dei punti di pressione.
- Neuropatia autonomica: alterata sudorazione e secchezza cutanea, che favoriscono la formazione di fessurazioni e ulcerazioni spontanee.
Vasculopatia periferica
La malattia arteriosa periferica (PAD) contribuisce in modo determinante, specialmente nei pazienti più anziani con lunga durata del diabete. È caratterizzata da:
- Riduzione del flusso sanguigno arterioso, soprattutto a livello infrapopliteo.
- Ischemia cronica, che compromette la capacità di guarigione delle lesioni.
- Maggiore rischio di infezione, necrosi e amputazione.
In circa il 50% dei pazienti con piede diabetico complicato, la componente ischemica è significativa (fonte: IWGDF 2023).
Traumi minori e carico meccanico anomalo
In presenza di neuropatia, anche microtraumi ripetuti (es. sfregamento da calzature inappropriate, camminata a piedi nudi) possono innescare ulcerazioni. Il carico plantare anomalo sulle aree di prominenza ossea determina ipercheratosi e successiva ulcerazione da pressione.
Infezione
Una volta che si forma un’ulcera, la penetrazione batterica è facilitata. Le infezioni del piede diabetico:
- Sono polimicrobiche (coinvolgono batteri aerobi e anaerobi).
- Evolvono rapidamente, passando da infezioni superficiali a osteomielite.
- Sono favorite dall’alterata funzione immunitaria nei pazienti diabetici (chetoacidosi, ridotta chemiotassi leucocitaria).
Risposta infiammatoria alterata
Il diabete comporta uno stato di infiammazione cronica di basso grado, con:
- Aumento delle citochine pro-infiammatorie (TNF-α, IL-6).
- Disfunzione dei macrofagi nella fase di guarigione delle ferite.
- Compromissione della sintesi di matrice extracellulare e angiogenesi.
Diabete → Neuropatia + Vasculopatia → Trauma → Ulcera → Infezione → Necrosi/Amputazione
Sintesi dei meccanismi patogenetici
Il piede diabetico origina dalla combinazione di più fattori: neuropatia, vasculopatia, traumi meccanici, infezione e infiammazione cronica. Questi processi interagiscono sinergicamente, portando a ulcere difficili da guarire e aumentato rischio di amputazione.
| Meccanismo | Descrizione sintetica | Effetti clinici principali |
| Neuropatia periferica | Danno alle fibre sensitivo-motorie e autonome per glicotossicità e ischemia, con perdita di sensibilità protettiva, atrofia muscolare e secchezza cutanea . | Ulcere da pressione non percepite, deformità del piede (dita a martello, Charcot), rischio di infezione aumentato |
| Vasculopatia periferica (PAD) | Aterosclerosi delle arterie infrapoplitee che riduce il flusso sanguigno e l’apporto di ossigeno ai tessuti . | Ischemia cronica, lenta guarigione delle ferite, necrosi distale, possibile amputazione |
| Traumi meccanici e carico anomalo | Microtraumi ripetuti da calzature inappropriate o sovraccarico plantare su aree prominenti, non avvertiti per la neuropatia . | Ipercheratosi, formazione di callosità, sviluppo di ulcere da pressione |
| Infezione (polimicrobica) | Colonizzazione batterica e anaerobica nelle ulcere, favorita da ischemia e ridotta difesa immunitaria locale . | Cellulite, fascite, osteomielite, sepsi, necessità di terapia antibiotica mirata |
| Infiammazione cronica | Stato pro-infiammatorio sistemico con aumento di TNF-α, IL-6 e disfunzione dei macrofagi, che ostacola riepitelizzazione e angiogenesi . | Guarigione ritardata delle ferite, formazione di tessuto cicatriziale fragile |
Note di approfondimento
- Neuropatia periferica: può essere sensitiva (perdita di dolore e temperatura), motoria (alterazione della biomeccanica) e autonomica (secchezza cutanea), con insorgenza spesso silente.
- Vasculopatia: la PAD è presente in circa il 50% dei casi complicati di piede diabetico e aumenta significativamente il rischio di amputazione.
- Traumi meccanici: l’incapacità di avvertire stimoli nocicettivi porta a lesioni da sfregamento e pressione non trattate tempestivamente.
- Infezione: il microbiota delle ulcere è generalmente polimicrobico; la diagnosi precoce di osteomielite è cruciale per evitare esiti sfavorevoli.
- Infiammazione: il diabete crea un microambiente infiammatorio cronico che interferisce con le fasi di riparazione tissutale, riducendo la risposta ai fattori di crescita locali.
3. Classificazione delle lesioni
3.1 Sistema Meggitt-Wagner
Questo schema valuta esclusivamente la profondità dell’ulcera e la presenza di tessuto necrotico o gangrena:
- Grade 0: cute intatta, lesione pre-ulcerativa o callosità senza discontinuità epidermica
- Grade 1: ulcerazione superficiale limitata all’epidermide e al derma
- Grade 2: lesione profonda che raggiunge tendini, capsule articolari o osso, ma senza ascessi od osteomielite
- Grade 3: presenza di ascesso profondo, osteomielite o sepsi articolare
- Grade 4: gangrena limitata a parte del piede (dito, avampiede)
- Grade 5: gangrena estesa a tutto il piede
Limiti: non considera esplicitamente infezione, ischemia o perdita di sensibilità, elementi fondamentali per la prognosi e la gestione multidisciplinare; per questo motivo alcune linee guida (es. NICE NG19) ne sconsigliano l’uso esclusivo per la stratificazione del rischio.
3.2 Sistema University of Texas (UT)
Il modello UT integra profondità (grade) e complicanze (stage) in una matrice 4×4, risultando maggiormente predittivo del rischio di amputazione.
| Stage A(pulito) | Stage B(infezione) | Stage C(ischemia) | Stage D(infezione + ischemia) | |
| Grade 0(pre/post-ulcera) | 0A | 0B | 0C | 0D |
| Grade 1(superficiale) | 1A | 1B | 1C | 1D |
| Grade 2(tendine/capsula) | 2A | 2B | 2C | 2D |
| Grade 3(osso/articolazione) | 3A | 3B | 3C | 3D |
- Grade 0–3: misura la profondità del difetto di cute e sottocute .
- Stage A–D: valuta segni clinici di infezione e/o ischemia periferica .
Questo sistema, validato su popolazioni diabetiche, ha dimostrato migliore correlazione con esiti sfavorevoli (non-guarigione, amputazione) rispetto alla classificazione Wagner; il rischio di amputazione cresce in modo significativo passando da 1A a 3D .
3.3 Altre classificazioni
- PEDIS (Perfusion, Extent, Depth, Infection, Sensation): sviluppato da IWGDF, assegna punteggi 1–4 a ciascun parametro, fornendo un profilo più dettagliato della lesione .
- S(AD)SAD: sistema che valuta Area, Depth, Sepsis, Arteriopathy e Denervation, pensato per l’uso clinico rapido .
In conclusione:
- Meggitt-Wagner rimane utile per una prima valutazione rapida ma va integrato con dati su infezione e perfusione.
- UT è preferibile per la sua capacità predittiva e guida terapeutica più precisa.
- PEDIS e altri modelli evoluti offrono valutazioni ancora più granulari, utili in centri specialistici e studi clinici.
4. Prevenzione
La prevenzione del piede diabetico si basa su una strategia integrata che include screening regolare del rischio, educazione e self-care, uso di calzature protettive, controllo glicemico ottimale, approccio multidisciplinare e tecnologie emergenti. Questo insieme di interventi riduce significativamente l’incidenza di ulcere e amputazioni, migliorando outcome e qualità di vita.
4.1 Screening dei fattori di rischio
Le linee guida NICE raccomandano una valutazione del rischio di piede diabetico almeno una volta all’anno nei pazienti a basso rischio e con frequenza più elevata (ogni 3–6 mesi) in quelli ad alto rischio. L’esame clinico include test di sensibilità con monofilamento da 10 g, palpazione dei polsi distali e ispezione di callosità, deformità, ulcerazioni e segni di infezione.
L’uso di strumenti di stratificazione (es. sistema SIGN, PEDIS) aiuta a identificare precocemente pazienti a maggior rischio di ulcerazione.
4.2 Educazione e self-care del paziente
Fornire educazione strutturata sulle misure di cura quotidiana: ispezione visiva del piede, igiene con acqua tiepida, asciugatura accurata e utilizzo di creme emollienti per evitare fessurazioni.
I pazienti devono essere incoraggiati a controllare i piedi ogni giorno e a rivolgersi subito al team sanitario in caso di lesioni sospette.
Programmi educativi multidisciplinari dimostrano una riduzione del 50% delle ulcere rispetto all’educazione standard.
4.3 Calzature protettive e off-loading
L’uso di calzature su misura o dispositivi di off-loading (stivali in plastica cast rimovibili o solette plantari) distribuisce la pressione e riduce il rischio di lesioni.
Anche calzature standard con soletta in materiale ammortizzante possono ridurre l’incidenza di ulcere del 30–50%.
È fondamentale verificare periodicamente lo stato delle scarpe e la loro vestibilità, sostituendole se usurate.
4.4 Controllo glicemico e gestione dei fattori di rischio
- Mantenere un HbA1c <7% riduce il rischio di neuropatia e vasculopatia periferica, due pilastri nella genesi del piede diabetico.
- Interventi sullo stile di vita (dieta, esercizio fisico) e trattamento di ipertensione e dislipidemia sono componenti essenziali per la prevenzione delle complicanze micro- e macrovascolari.
- Il fumo deve essere fortemente scoraggiato: i fumatori presentano un rischio di PAD e di amputazioni significativamente più alto.
4.5 Team multidisciplinare e follow-up
L’istituzione di un Foot Protection Team (diabetologo, podologo, infermiere, chirurgo vascolare, ortopedico) garantisce monitoraggio continuo e rapido intervento su lesioni precoci.
Visite di follow-up trimestrali per i soggetti a rischio alto e semestrali per quelli a rischio moderato permettono di intercettare precocemente nuovi segni di danno.
La coordinazione tra medicina di base e centri specialistici migliora l’aderenza alle raccomandazioni e la gestione tempestiva delle complicanze.
4.6 Tecnologie emergenti e telemedicina
- Sensori indossabili e termometri plantari monitorano in tempo reale la temperatura e la pressione, segnalando anomalie prima della comparsa dell’ulcera.
- Piattaforme di telemedicina facilitano l’accesso a valutazioni rapide in aree rurali o soggetti con mobilità ridotta, riducendo il delay diagnostico.
- App dedicate alla documentazione fotografica quotidiana delle aree a rischio consentono di condividere immagini cliniche con il team in tempo reale.
5. Trattamento
Un approccio multidisciplinare è la pietra angolare del trattamento del piede diabetico, integrando diabetologo, infermiere specializzato, podologo, chirurgo vascolare e ortopedico per ottimizzare gli outcome.
5.1 Off-loading
La riduzione della pressione plantare (“off-loading”) tramite stivali in plaster cast rimovibili o calzature su misura accelera la guarigione delle ulcere riducendo la pressione fino al 70%.
5.2 Debridement
Il debridement chirurgico o meccanico rimuove tessuto necrotico e biofilm, favorendo la fase di proliferazione e migliorando il tasso di chiusura delle ferite.
5.3 Medicazioni avanzate e terapie locali
Le medicazioni con idrocolloidi, schiume impregnate e saccarosio-octasolfato sono raccomandate per lesioni non infette di difficile guarigione.
5.4 Terapia antibiotica
Nei casi di infezione moderata-grave è necessaria una terapia antibiotica mirata in base all’esame colturale; le linee guida IDSA/ADA raccomandano di iniziare con un regime empirico coprendo Gram-positivi e-negativi fino ai risultati definitivi.
5.5 Rivascolarizzazione
In presenza di PAD con ischemia critica (indice caviglia-braccio <0,9), l’angioplastica endovascolare e il bypass chirurgico migliorano del 50–70% le probabilità di guarigione delle ulcere ischemiche .
5.6 Controllo glicemico
Un controllo intensivo dell’HbA1c (target <7%) è associato a una riduzione del 30% delle complicanze microvascolari, inclusa la neuropatia che predispone alle lesioni del piede.
6. Terapie avanzate
6.1 Terapia a pressione negativa (NPWT)
La Negative Pressure Wound Therapy applica una pressione continua o intermittente tra –75 e –125 mmHg, stimolando angiogenesi e riducendo l’edema, con un’accelerazione della chiusura del 20–30% rispetto al trattamento standard.
6.2 Fattori di crescita e innesti dermici
L’applicazione topica di fattori di crescita (PDGF, EGF) o innesti di derma rigenerato incrementa del 40% il tasso di chiusura completa delle ulcere refrattarie dopo 4–6 settimane di terapia standard.
6.3 Terapie cellulari e ingegneria tissutale
Gli studi su cellule staminali autologhe (midollo osseo, adipose-derived) mostrano un miglioramento del 60–80% della rigenerazione tissutale e una riduzione del tasso di amputazione del 20%.
6.4 Altre tecnologie emergenti
Ultrasuoni a bassa frequenza e onde d’urto extracorporee sono in fase sperimentale e hanno evidenziato un aumento dell’espressione di VEGF e di neoangiogenesi nelle aree trattate.
Tabella 1 – Esiti delle terapie avanzate
| Terapia | Tasso di guarigione completa | Riduzione del rischio di amputazione |
| Cura standard (trattamento convenzionale) | 75% dei DFU guariti entro 12 settimane | – |
| Negative Pressure Wound Therapy (NPWT) | – | OR 0,53 (95% CI 0,37–0,74) p = 0,0002 per riduzione delle amputazioni |
| Platelet-Derived Growth Factor (PDGF) | Aumento significativo della probabilità di guarigione rispetto al controllo | – |
| Epidermal Growth Factor (EGF) | Promozione significativa della guarigione rispetto al placebo | – |
Fonti:
- Negative Pressure Wound Therapy (NPWT)
- Meta-analisi che include 17 studi (13 RCT + 4 nRCT) su 831 pazienti con NPWT vs 834 con terapia standard, che mostra un’accelerazione significativa della guarigione del DFU (OR 2,57; 95% CI 1,72–3,85; p < 0,0001) link: https://pmc.ncbi.nlm.nih.gov/articles/PMC11036310
- Riduzione del rischio di amputazione con NPWT (OR 0,53; 95% CI 0,37–0,74; p = 0,0002) link: https://pubmed.ncbi.nlm.nih.gov/38651532/
- Platelet-Derived Growth Factor (PDGF)
- Trial clinico su 28 pazienti con DFU che dimostra efficacia del rhPDGF-BB sulla guarigione delle ulcere croniche quando associato a buona medicazione standard, link: https://pubmed.ncbi.nlm.nih.gov/16799381/
- Studio retrospettivo su 24.898 pazienti in centri di wound care: RR per guarigione 1,32 (95% CI 1,22–1,38), RR per amputazione 0,65 (95% CI 0,54–0,78), link: https://myhealthplanner.com/web/public/brands/medicalpolicy/external-policies/recombinant-and-autologous-platelet-derived-growth-factors-for-wound-healing-and-other-non-orthopedic-conditions
- Epidermal Growth Factor (EGF)
- Meta-analisi di 7 RCT (610 partecipanti) che mostra un aumento significativo della probabilità di guarigione con rhEGF topico (RR 1,54; 95% CI 1,30–1,83; I² = 18%), link: https://pubmed.ncbi.nlm.nih.gov/31394225/
- Analisi comparativa che conclude che EGF promuove significativamente la chiusura delle ulcere rispetto al placebo, link: https://pmc.ncbi.nlm.nih.gov/articles/PMC10587659
Tabella 2 – Rivascolarizzazione e salvataggio dell’arto
| Intervento | Outcome | Statistica |
| Angioplastica endovascolare | Salvataggio dell’arto a 1 anno | 56% di limb salvage rate in assenza di flusso diretto pre-ricanalizzazione |
| Bypass chirurgico | Salvataggio dell’arto a 1 anno | Simile o lievemente superiore rispetto all’endovascolare (non specificato nei trial) |
| Amputazioni LE (lower extremity) | Pazienti con DFU che subiscono amputazione | 18,8% dei pazienti in uno studio decennale su 4.676 soggetti |
| Incidenza a vita di amputazione | Pazienti diabetici | 20% – lifetime lower‐extremity amputation |
Fonti:
- Angiosome-targeted angioplasty
- Meta-analisi di 4 studi che evidenzia un miglior tasso di limb salvage (OR 2,21; p = 0,001) e di wound healing (OR 3,29; p < 0,001) rispetto a PTA non angiosomica .
- Bypass chirurgico vs endovascolare
- Serie non randomizzate: limb salvage a 1 anno mediano 85% (IQR 80–90%) per bypass open e 78% (IQR 70–89%) per rivascolarizzazione endovascolare
- Amputazioni
- Studio su 4.676 pazienti con DFU: 18,8% subisce amputazione arto inferiore
- Lifetime lower-extremity amputation
- Incidenza cumulativa di amputazione nell’arco della vita pari al 20% tra pazienti diabetici .
Tabella 3 – Recidiva delle ulcere da piede diabetico
| Regione | Tasso di recidiva per persona-anno (%) | 95% CI |
| Globale | 22,1 | 19,0–25,2 |
| Europa | 24,9 | 20,0–29,7 |
| Nord America | 17,8 | 12,7–22,9 |
| Africa | 16,9 | 4,7–29,0 |
| Asia | 17,0 | 11,1–23,0 |
Fonti:
- Globale: 22,1% per persona-anno (95% CI 19,0–25,2)
- Europa: 24,9% (95% CI 20,0–29,7)
- Nord America: 17,8% (95% CI 12,7–22,9)
- Africa: 16,9% (95% CI 4,7–29,0)
- Asia: 17,0% (95% CI 11,1–23,0)
- Recidiva a 1 anno: circa 40% dei pazienti presenta nuova ulcera entro 1 anno dalla guarigione
Tabella 4 – Mortalità a 5 anni
| Condizione | Mortalità a 5 anni (%) |
| Pazienti con ulcera DFU | ~30% |
| Pazienti con amputazione maggiore | >70% |
Fonti:
Pazienti con DFU: ~50% di mortalità a 5 anni (cardiovascolare e infezione principali cause) .
Pazienti con amputazione maggiore: 56,6% di mortalità a 5 anni, superiore a molti tumori (es. 9% mammella, 80% polmone)
7. Aspetti chirurgici
7.1 Chirurgia correttiva e ricostruttiva
La correzione delle deformità (dita a martello, esostosi) con osteotomie plantari riduce i punti di iperpressione e previene le recidive ulcerative .
7.2 Amputazioni parziali e totali
Le amputazioni parziali (dito, avampiede) sono preferite rispetto a quelle maggiori per preservare la funzione, ma richiedono una valutazione integrata di grado Wagner, PAD e stato generale del paziente .
7.3 Gestione dell’osteomielite
In caso di osteomielite confermata, le linee guida raccomandano resezione chirurgica del tessuto necrotico con visuale diretta dell’osso, seguita da antibiotici per almeno 6 settimane .
8. Follow-up e prognosi
8.1 Follow-up post-guarigione
Dopo la chiusura dell’ulcera, è consigliato un follow-up ogni 1–3 mesi nel primo anno per monitorare nuova formazione di callosità, ischemia o infezioni recidive.
8.2 Prevenzione delle recidive
Interventi di mantenimento includono calzature protettive continue, fisioterapia plantare e controlli periodici dei fattori di rischio metabolici; nonostante ciò, il tasso di recidiva a 1 anno rimane intorno al 40%.
8.3 Indicatori di prognosi e mortalità
Il rischio di amputazione maggiore a 5 anni varia dal 10% al 20% in base alla gravità iniziale della lesione; la mortalità a 5 anni post-ulcera supera il 50%, simile a quella di alcuni tumori, sottolineando la gravità dell’evento.
FAQ
Quanto spesso va controllato il piede in un paziente diabetico?
Screening annuale consigliato, con valutazione del rischio più frequente nei casi ad alto rischio.
Qual è la terapia off-loading più efficace?
Stivaletto in plaster cast rimovibile, bilanciamento tra compliance e riduzione pressione.
Quando è indicata la rivascolarizzazione?
In presenza di ischemia critica (indice caviglia-braccio < 0,9) o lesioni refrattarie dopo 4–6 settimane.
Bibliografia
- Linee Guida IWGDF 2023 – Prevention and Management of Diabetes‐related Foot Disease.
- Diabetic Foot Problems: Prevention and Management, NICE NG19 (Last reviewed January 2023).
- American Diabetes Association. Standards of Medical Care in Diabetes 2023.
- SIMG. Piede diabetico: approccio terapeutico multidisciplinare (2018).
- SID/SIMG. Linee Guida e Standard di cura (febbraio 2024).
- Medscape. Diabetic Foot Ulcers Treatment & Management, April 2025.
- NCBI Bookshelf. Diabetic foot problems: prevention and management.
- UNIVADIS – Linee guida NICE: prevenzione e gestione del piede diabetico (2024).
- Urgo Medical. Linee Guida IWGDF 2023: medicazioni impregnate di saccarosio‐octasolfato.
- Verywell Health. What Is Diabetic Peripheral Neuropathy? (2021).
- Verywell Health. Diabetic Foot: Charting the Course of the Effect on Feet (2023).
- The Guardian. More than 100,000 Americans with diabetes have limbs amputated each year (luglio 2024).
- Diabetes.org. Diabetes Foot Care: Tips for Healthy Feet & Preventing Complications.
- IWGDF. University of Texas and Meggitt‐Wagner classifications.
- NICE NG19. Guidance on off‐loading and frequency of foot reviews.
Reazione NurseTimes
Articoli correlati
- Lesioni da pressione: responsabilità infermieristica
- Raccomandazioni per la valutazione e gestione delle lesioni da pressione del tallone
- V di Vulnologia: Come valutare il rischio di sviluppare lesioni da pressione
- Piede diabetico: una soluzione dalla medicina rigenerativa
- Piede diabetico: innovativa terapia cellulare autologa per ridurre amputazioni
Scopri come guadagnare pubblicando la tua tesi di laurea su NurseTimes
Il progetto NEXT si rinnova e diventa NEXT 2.0: pubblichiamo i questionari e le vostre tesi
Carica la tua tesi di laurea: tesi.nursetimes.org
Carica il tuo questionario: https://tesi.nursetimes.org/questionari









Lascia un commento