Autori: Milella Michaela, Burdi Maria Teresa, Visci Francesca, Angelini Gessica, Zatton Margherita, Manzari Raffaele, Brancale Filippo, Brancale Graziana, Dentico Domenico
L’accesso venoso periferico nel neonato
Per accesso venoso periferico (AVP) si intende il posizionamento di un dispositivo vascolare nel circolo venoso periferico, la cui punta non è allocata in cava superiore, in atrio destro o in cava inferiore.
La procedura si rende necessaria, prevalentemente, per:
- Somministrare terapia idratante.
- Integrare, in caso di necessità, la nutrizione enterale.
- Somministrare farmaci.
- Eseguire terapia endovenosa in emergenza.
- Somministrare sangue ed emoderivati.
La procedura è considerata semi-invasiva e non è esente da complicanze. Gli esiti sulla salute del bambino e sull’efficienza dell’organizzazione saranno positivi se verranno adottate pratiche di posizionamento e gestione evidence-based da parte di personale specificamente formato.
Sebbene questa procedura sia molto utilizzata in terapia intensiva neonatale vi è ancora una scarsa consapevolezza dei potenziali rischi associati. Le vene più accessibili nel neonato si trovano frequentemente sul dorso della mano, al malleolo, alla piega del gomito e allo scalpo.
Il dispositivo maggiormente utilizzato è un ago-cannula standard in Teflon o Poliuretano di calibro 24G e 26G. In neonati a termine, che presentano calibri venosi maggiori, è possibile impiantare un ago-cannula da 22G (azzurro).
Classificazione dei cateteri periferici
I cateteri periferici si suddividono in:
- Cannule periferiche corte (3 – 6 cm) a breve termine (< 7 gg), di diverso calibro misurato in gauge, codificate attraverso un colore (22 G azzurro, 24 G giallo, 26 G violetto). Possono essere con o senza alette. Nei neonati è preferibile usare cannule prive di alette per agevolare l’introduzione ed evitare un maggior rischio di lesioni da decubito. Questi dispositivi devono essere compatibili con la risonanza magnetica (Magnetic Resonance Tomography – MRT), essere radiopachi e privi di lattice, PVC (polivinilcloruro) e DEHP (dietilesilftalato). Sono costituite da un ago-mandrino metallico all’interno del catetere. Una volta punta la vena il sangue refluisce e riempie la camera trasparente, il catetere ed il mandrino vengono fatti progredire lungo l’asse del vaso per un paio di mm e a questo punto il catetere viene spinto fino in fondo mentre il mandrino viene ritirato. Si raccomanda di evitare, per quanto possibile, l’incannulamento di vene in aree di flessione degli arti come la piega del gomito. L’inserimento di queste cannule avviene con tecnica diretta cioè direttamente attraverso l’ago (catheter through needle), in vene superficiali dell’avambraccio, braccio, malleolo e scalpo. Il cono del catetere viene, poi, raccordato ad un connettore Luer ISO compatibile.

- Cannule periferiche lunghe o ‘mini-midline’ (durata da > 7 gg a 1 mese). La lunghezza è superiore a quella delle cannule corte ma inferiore a quella dei midline tradizionali (6-12 cm). Vengono inserite solitamente con tecnica di Seldinger diretta facendo scorrere il catetere su un filo guida in nitinol (catheter over guidewire), precedentemente introdotto nel vaso attraverso un ago. Queste cannule vengono utilizzate in vene superficiali dell’avambraccio e braccio oppure in vene profonde con tecnica ecoguidata e posizionate non oltre il cavo ascellare.
- Midline veri e propri o ‘midclavicular’: lunghi 20-25 cm, durata 1-3 mesi. Vengono di solito posizionati, per via ecografica, in vene profonde del braccio (vena basilica, vene brachiali, vena cefalica) a livello del terzo medio del braccio, la cui punta si posiziona solitamente nel tratto toracico della vena ascellare o in vena succlavia. In genere per l’inserimento di questi cateteri si utilizza la tecnica di Seldinger indiretta o modificata con l’aiuto di un introduttore-dilatatore (catheter through introducer). La tecnica prevede l’inserimento dell’introduttore-dilatatore sul filo guida, la rimozione del filo guida e la progressione del catetere nell’introduttore-dilatatore, che viene poi ‘sbucciato’ (peel away) e asportato. La tecnica di Seldinger indiretta viene usata generalmente per i cateteri a medio-lungo termine perché sono dispositivi più lunghi e più morbidi, che non potrebbero essere introdotti in vena senza un introduttore-dilatatore.
Calibri e flussi
Il diametro (calibro) esterno dei cateteri vascolari viene espresso in French (Fr) o Charrière (Ch), che corrisponde a 1/3 di millimetro (mm): 1 Fr = 0,33 mm e quindi 1 mm = 3 Fr.
Il Gauge (G), che in inglese significa ‘calibro’, è una unità di misura, che pur non facendo parte del sistema Sistema Internazionale viene comunque utilizzata in medicina. E’ la misura dell’area interna di un catetere e corrisponde al numero di cateteri che affiancati occupano lo spazio di 1 cm², ragion per cui all’aumentare dei gauge si riduce il calibro dei cateteri (il 26 G è più piccolo del 24 G e quest’ultimo del 22 G). Il Gauge è in pratica l’inverso del centimetro quadrato (24 G = 1/24 di cm²). Questa misura viene comunemente applicata alle cannule periferiche corte.
Il flusso all’interno del catetere varia a secondo della densità del liquido infuso, diametro e lunghezza della cannula vascolare diminuendo con:
- L’aumentare della densità del liquido.
- La riduzione del diametro della cannula.
- L’aumentare della lunghezza della cannula.

In figura tabella di conversione, dove si riporta anche il codice-colore internazionale corrispondente agli aghi-cannula maggiormente utilizzati.
Protocollo RaSuVA
RaSuVA è un acronimo che significa Rapid Superficial Vein Assessment che caratterizza un protocollo di valutazione sistematica del patrimonio venoso superficiale del neonato attraverso una visione diretta, per contatto mediante transilluminazione (VeinLite, Venoscope) o utilizzando tecnologia NIR (Near InfraRed) con o senza laccio emostatico, consentendo di:
- Mappare le vene superficiali.
- Scegliere la vena più idonea.
- Aumentare la probabilità di successo alla prima venipuntura.
- Preservare le vene del neonato.
Utilizzo della tecnologia NIR (Near InfraRed)
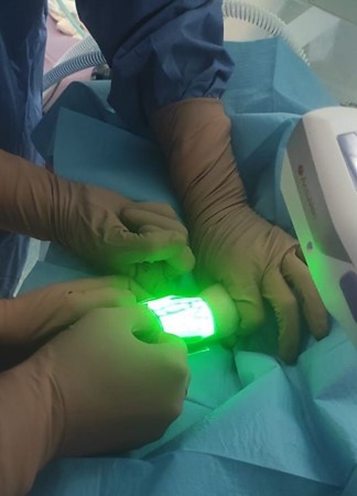
La tecnologia NIR è applicata in alcune apparecchiature e permette in qualche modo la visualizzazione di vene superficiali. Questi dispositivi utilizzano la luce nello spettro del vicino infrarosso ossia una radiazione ottica appena fuori del campo del visibile con lunghezza d’onda di 760 nm. L’irradiazione infrarossa è in grado di penetrare la cute ad angolo retto fino a 10 mm di profondità da una distanza di 61 cm.
L’emoglobina deossigenata come quella presente nel sangue venoso assorbe questa radiazione in misura maggiore rispetto ad altri tessuti biologici. Lo strumento acquisisce l’immagine e le elabora in tempo reale offrendo una mappa venosa in modo più evidente rispetto alla visione ad occhio nudo.
I sistemi che utilizzano questa tecnologia sono VeinSite® (visualizzazione diretta mediante casco che permette di avere le mani libere e lavorare più agevolmente), VeinViewer® e AccuVein® (visualizzazione indiretta).
Queste apparecchiature sono molto utili soltanto per evidenziare le vene superficiali entro 8-10 mm di profondità e quindi nel posizionamento di cannule periferiche corte e cannule periferiche lunghe.
Ordine di preferenza nella scelta della vena nel neonato
- Arti inferiori (vena safena interna al malleolo)
- Dorso delle mani (vene metacarpali dorsali) e polso (vena cefalica dell’avambraccio sulla linea del pollice, vena basilica dell’avambraccio sulla linea dell’indice).
- Scalpo (vena temporale superficiale e vena auricolare posteriore).
- Fossa del gomito (vena antebrachiale, vena mediana cefalica, vena mediana basilica o vena cubitale).
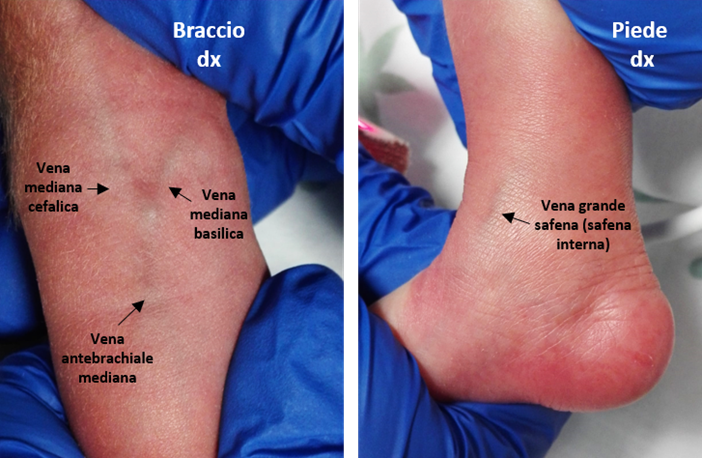
A sinistra particolare delle vene nella fossa cubitale o fossa del gomito, a destra particolare della vena safena interna al malleolo mediale.
Materiale e tecniche costruttive dei cateteri
Le caratteristiche ideali dei cateteri vascolari includono:
- Biocompatibilità.
- Biostabilità.
- Assenza di interazioni con i farmaci.
- Assenza o scarsa trombogenicità.
- Resistenza alle infezioni.
- Resistenza all’inginocchiamento (kinking).
- Leggerezza.
- Radiopacità.
- Non interferenza con gli strumenti diagnostici.
Per quanto riguarda i materiali di costruzione si utilizza il silicone, poliuretano e teflon. Il poliuretano – PUR di ultima generazione (Carbothane®,Chronoflex®,Pellethane®) è il materiale maggiormente utilizzato per la produzione dei cateteri vascolari. Il silicone (SIL) si usa sempre meno perché, pur avendo una buona biocompatibiltà, basso rischio di trombosi, una maggiore resistenza alle infezioni e scarsa interferenza con i farmaci presentano maggior rigidità e fragilità in quanto nella costruzione viene mescolato con il solfato di bario per renderlo radiopaco e più consistente.
Invece i cateteri in poliuretano sono notevolmente evoluti da quelli di prima generazione (PUR aromatici) fino a quelli di seconda, terza e quarta generazione (Power – PUR alifatici) che sono più morbidi, maggiormente biocompatibili, resistenti all’alcol e alla trazione. Per queste caratteristiche strutturali di resistenza presentano un calibro interno maggiore rispetto ai cateteri in silicone (a parità di frenciaggio) avendo le pareti più sottili ma più resistenti.
Il teflon o PTFE (Vialon®) è un materiale rigido e meno biocompatibile rispetto al poliuretano e silicone, ma facile da manovrare. Il teflon inoltre si associa ad un aumentato rischio trombotico. Viene utilizzato per la costruzione dell’ago-cannula.
I presidi per l’accesso venoso periferico
Tra i presidi utilizzati includiamo:
- Kit di inserimento omnicomprensivo (se a disposizione altrimenti crearlo inserendo tutto il necessario in una busta).
2. Applicatore monodose sterile di clorexidina 2% in alcol isopropilico (IPA) al 70% (1 ª scelta) preferibilmente colorato da utilizzare per l’antisepsi cutanea sia prima dell’impianto che al momento del cambio della medicazione con tecnica asettica e ‘no touch’ per 30 secondi lasciando asciugare per altri 30 secondi. Le soluzioni di iodopovidone al 10% (2ª scelta) sono meno efficaci e andrebbero utilizzate solo per pazienti allergici alla clorexidina.
I tempi di contatto, cioè di asciugatura dell’antisettico sulla cute, dei vari prodotti per ottenere una efficace antisepsi, sono i seguenti:
- Clorexidina in alcol 30 sec.
- Clorexidina in soluzione acquosa 2 minuti.
- Iodopovidone 2 minuti.
La clorexidina rispetto allo iodopovidone presenta diversi vantaggi come un più ampio spettro d’azione, maggior durata dell’effetto antisettico ed una efficace azione antifungina.
Lo iodopovidone viene inattivato dalla presenza di liquidi biologici come sangue, siero e secrezioni e potrebbe interferire sulla funzionalità della tiroide in fase di sviluppo del neonato.
L’alcol isopropilico è da preferire all’alcol etilico per la sua minore aggressività sulla cute e sui cateteri in silicone e poliuretano. Nel bambino < 2 mesi non esiste un proprio divieto all’utilizzo della clorexidina, ma solo un rilevante invito all’utilizzo con cautela minimizzando le reazioni, senza rinunciare ai notevoli vantaggi della clorexidina, con alcune precauzioni, come uso della minima quantità possibile di antisettico senza strofinare la cute, utilizzo di applicatore monodose sterile, rimozione di tutta la clorexidina in eccesso, utilizzo di soluzione fisiologica dopo l’applicazione e asciugatura della clorexidina.
3- Dispositivi adesivi di fissaggio (Sutureless)
Per evitare la dislocazione del catetere si utilizzano dispositivi sterili specifici che si chiamano Sutureless Devices (SD) o Engineered Stabilization Device (ESD) che, per i cateteri periferici, sono presenti come sistemi ad adesività cutanea (SAC). Consentono di ridurre i movimenti di ‘in and out’ garantendo una migliore stabilità del cono del catetere.
4- Colla istoacrilica
Il sito di ingresso del catetere può essere sigillato con colla sterile, in confezione monodose, al cianoacrilato (istoacrilica), non tossica, che oltre a previene il sanguinamento costituisce, nel contempo, una valida barriera antimicrobica. E’ sufficiente applicare una minima quantità di colla circa 0,2 ml intorno all’exit-site per garantire stabilità al catetere, ridurre il rischio di dislocazione del dispositivo, bloccare il sanguinamento e creare una barriera all’ingresso di batteri per via extra-luminale. L’associazione sutureless, colla istoacrilica e membrana trasparente garantisce la massima stabilizzazione e protezione del sito di emergenza del catetere. Considerare, comunque, eventuali lesioni cutanee associate ad adesivi medici (MARSI), secondarie all’uso dispositivi di stabilizzazione ad adesività cutanea. Prima della sua applicazione rimuovere accuratamente residui di sangue.
5- Medicazioni trasparenti semipermeabili
Le medicazioni consigliate sono quelle trasparenti semipermeabili in film adesivo di poliuretano, ipoallergenico e privo di lattice e quindi ad alta tollerabilità, impermeabile ai liquidi, batteri e virus possibilmente bordate, che consentono di ispezionare facilmente il sito di inserzione (exit-site), impedendo la dislocazione della cannula.
Devono essere dotate di alta traspirabilità, caratteristica che consente una ossigenazione e una evaporazione ottimali sotto la medicazione. La traspirabilità è definita dalla Moisture Vapour Transmission Rate (MVTR) o Water Vapor Transmission Rate (WVTR), proprietà che indica il passaggio del vapore acqueo nell’unità di tempo, attraverso una sostanza, che in questo caso è rappresentata dalla medicazione trasparente.
Una MVTR elevata significa ridurre l’umidità e mantenere asciutta la cute sotto la medicazione, ottenere un fissaggio più sicuro e una minore colonizzazione batterica, con riduzione del rischio di infezioni (un ambiente caldo umido, invece, favorirebbe la proliferazione di microrganismi). Quindi è raccomandato applicare una medicazione trasparente semipermeabile ad elevata traspirabilità idealmente sopra i 3.000 g/mq/die (accettabile anche maggiore di 1500 g/mq/die), che può essere sostituita ogni 7 giorni o prima se visibilmente sporca, staccata o bagnata (indicare sulla medicazione sempre la data di applicazione).
L’applicazione della medicazione va effettuata indossando guanti puliti o sterili. Deve essere sostituita se si bagna, si stacca o se visibilmente sporca, con tecnica asettica, osservando il sito di inserzione e garantendo una buona visibilità delle estremità. Una volta effettuata la medicazione, applicare un’etichetta con data, orario, iniziali dell’operatore. Se i pazienti presentano segni/sintomi di infezione bisogna rimuovere la medicazione e valutare in modo più approfondito la sede. In caso contrario, non va rinnovata regolarmente ma nel momento del riposizionamento del CVP.
6- Prolunghe di estensione (extension-set) della linea
Queste prolunghe devono avere un esiguo priming volume tra il dispositivo per accesso vascolare (DAV) e linea infusionale. E’ raccomandato utilizzare il minor numero possibile di extension-set per ridurre il potenziale rischio di contaminazione e infezione.
7- Connettori senza ago o cappucci a valvola (Needle Free Connector, NFC)
Essi riducono i rischi legati alle punture accidentali da parte dell’operatore e di contaminazione e di occlusione del catetere, evitando il ‘back flow’ alla deconnessione del sistema. Scegliere sempre i connettori a pressione neutra perché sono quelli che riducono il rischio di infezioni e di occlusioni. Vengono cambiati al momento della sostituzione della linea infusionale oppure se vengono contaminati o se non utilizzati ogni 7 giorni.
8-Cappucci a valvola a pressione neutra (Port Protector)
Sono dispositivi raccomandati per la protezione delle porte (hub) di accesso del catetere e quindi per la protezione e gestione della linea infusionale. Sono sistemi di chiusura dei cateteri con modalità di connessione senza ago e dotati di raccordo luer-lock, che all’interno contengono una spugnetta imbevuta di alcol isopropilico al 70% o clorexidina 2% (disinfezione passiva).
9- Siringhe preriempite sterili di soluzione fisiologica per lavaggio catetere (flushing)
Importante per lavare e/o chiudere (flush e lock) la via infusionale con tecnica pulsata ‘start and stop’ (crea un flusso turbolento) possibilmente utilizzando siringhe pre-riempite sterili, evitando di creare il ‘back flow’. Il volume di lavaggio deve essere il doppio dello spazio morto.
La chiusura del dispositivo non utilizzato (locking) si effettua, ogni 24 ore, infondendo lentamente un volume di soluzione fisiologica uguale allo spazio morto del catetere + 10%.
10- Filtri antiparticolato
Le evidenze attuali circa il loro utilizzo non consentono di poter generalizzare i risultati, purtuttavia sono presenti in letteratura diversi studi che hanno dimostrato che il loro impiego abbia ridotto l’incidenza di flebiti da cannule periferiche corte in ambito pediatrico usando filtri da 0,2 micron e riduzione di infezione da Candida Albicans con filtri da 1,2 micron. In commercio sono presenti filtri in linea che oltre a trattenere particelle di vario tipo (gomma, vetro, polvere, aggregati lipidici, precipitati farmacologici, batteri ed endotossine) e dimensione (da 5 a più di 50 micron) eliminano bolle di aria (air eliminating system). Questi dispositivi sono fortemente raccomandati in bambini con shunt cardiaci e polmonari dx-sx per evitare che aria e particelle inerti possano raggiungere la circolazione arteriosa.
Procedura di inserimento del catetere vascolare periferico
La procedura prevede i seguenti punti:
- Preparare il materiale necessario.
- Controllare l’associazione della procedura al corretto paziente.
- Informare i genitori del neonato. Spiegare la procedura ai genitori se presenti e coinvolgerli il più possibile.
- Creare ambiente sicuro e confort al neonato.
- Posizionare l’incubatrice a un’altezza comoda e garantire una illuminazione corretta, proteggendo il neonato dall’esposizione alla luce diretta.
- Valutare il patrimonio venoso con visione diretta o con tecniche di visualizzazione per individuare la vena ideale o la migliore disponibile che sia possibilmente palpabile con decorso più lineare possibile e che sia piena e si riempia velocemente una volta rilasciata la digitopressione (protocollo RaSuVA).
- Eseguire il lavaggio antisettico delle mani.
- Predisporre il campo di lavoro rispettando l’asepsi (tecnica no-touch); aprire e disporre il materiale, riempire il deflussore con la soluzione prescritta.
- Identificare e scegliere la vena idonea.
- Posizionare il neonato considerando la sede di accesso venoso.
- Far contenere il neonato da un altro infermiere e somministrare qualche goccia di saccarosio per bocca.
- Eseguire lavaggio antisettico delle mani.
- Indossare i DPI e guanti puliti (non è necessario utilizzare guanti sterili), l’importante è utilizzare la tecnica ‘Non-Touch’ (Aseptic Non Touch Technique – ANTT).
- Evitare il laccio emostatico ma preferire il riempimento manuale della vena.
- Eseguire l’antisepsi ‘a bande’ con delicati movimenti senza ripassare rispettando i tempi di contatto (riduce notevolmente la carica microbica cutanea). Questo metodo è da preferire a quella circolare.
- Smaltire correttamente il materiale utilizzato per l’antisepsi.
- Aspettare che il sito si asciughi (20 sec. per la clorexidina 2% in alcol isopropilico 70%)
- Inserire la cannula rispettando una angolazione di circa 10-30° con la smussatura (ugnatura o taglio obliquo) dell’ago rivolta verso l’alto.
- Al ritorno venoso ridurre l’inclinazione e continuare l’inserimento per altri 2 mm circa (il ritorno venoso, nei neonati molto piccoli o con patrimonio venoso scarso, non è sempre presente o si manifesta dopo qualche secondo). Questa azione riduce il rischio di trapassare la vena.
- Iniziare a rimuovere l’introduttore (il mandrino serve solo a pungere la vena) mentre si inserisce la cannula.
- Rimuovere completamente l’introduttore, che andrà immediatamente smaltito nei contenitori per aghi e taglienti.
- Connettere prolunga e NFC e somministrare un flush di soluzione fisiologica allo 0.9%.
- Rimuovere ogni traccia di sangue sul sito prima di applicare la medicazione.
- Posizionare un dispositivo cutaneo sterile adesivo (SAC) per fermare e stabilizzare il catetere e ridurre il rischio di decubito del cono sulla cute.
- Applicare una piccola quantità di colla istoacrilica sul sito cutaneo di ingresso del catetere (circa 0,20 ml). La colla fermerà qualsiasi sanguinamento e trasudamento, riducendo la contaminazione batterica e migliorando la stabilizzazione del dispositivo.
- Posizionare la medicazione trasparente semipermeabile sterile.
- Rimuovere i guanti ed eseguire l’igiene antisettica delle mani.
- Avviare l’infusione controllando che non vi sia infiltrazione.
- Smaltire correttamente i rifiuti.
- Eseguire l’igiene antisettica delle mani.
- Registrare la procedura sulla cartella infermieristica.
- Continuare a garantire il confort al paziente.
Asepetic Non-Touch Technique (ANTT)
E’ una tecnica asettica specifica e ben definita, il cui scopo è quello di proteggere le Parti-Chiave (parti dei dispositivi, punta della siringa, estremità luer maschio e/o spike del set di infusione, raccordo luer del needle free connector, ecc…) e i Siti-Chiave (zone della cute del paziente che costituiscono una porta di accesso per l’invasione dei microrganismi, come i siti di inserzione dei cateteri vascolari, i siti di iniezione o ferite aperte).
Distinguiamo due tipi di ANTT:
- ANTT-Standard, che si utilizza per procedure semplici, di breve durata in cui ci sono poche e piccole Parti-Chiave, semplici da proteggere (ad es. preparazione e somministrazione di farmaci o il posizionamento di una cannula periferica corta). Questa tecnica richiede il lavaggio delle mani, guanti puliti non sterili ma sterili se è necessario toccare le parti-chiave e le zone-chiave, corretta scelta e allestimento del campo di lavoro (raccomandato un piccolo telo sterile monouso o superficie precedentemente disinfettata), protezione delle parti chiave (cappucci sterili, tappini sterili, ecc…), utilizzo corretta della tecnica ‘Non-Touch’.
- ANTT-Chirurgica per procedure complesse, di lunga durata in cui sono interessate tante e grandi Parti-Chiave (es. posizionamento di un Catetere Venoso Centrale – CVC). Questa tecnica prevede il lavaggio delle mani, utilizzo di un grande telo sterile (>80% del paziente), carrello servitore precedentemente disinfettato coperto da grande telo sterile, protezione delle parti chiave (cappucci sterili, tappini sterili, ecc…), precauzioni di barriera aggiuntive necessarie, come mascherina chirurgica non sterile, copri-capo non sterile, guanti sterili, camici sterili. Non è necessaria la tecnica ‘Non-Touch’ nel contesto di una procedura in un campo sterile.
Gestione delle linee infusionali
Le linee infusionali permettono, insieme al catetere venoso, la somministrazione della terapia endovenosa e una loro corretta gestione consente di ridurre/evitare le complicanze anche gravi come le infezioni o le occlusioni.
I set infusionali vanno sostituiti:
- Ogni 96 ore.
- Dopo 4 ore dall’inizio dell’infusione di sangue o prodotti del sangue.
- Entro 24 ore dall’inizio dell’infusione in caso di somministrazione di emulsioni lipidiche.
Per alcuni farmaci occorre seguire le indicazioni dell’azienda produttrice rispetto ai tempi di sostituzione dei set.
Inoltre:
- Minimizzare l’utilizzo di dispositivi aggiunti (add-on devices) lungo la linea infusionale, rappresentando ogni dispositivo una ulteriore fonte di contaminazione, deconnessione ed errori di utilizzo.
- Usare preferibilmente linee infusionali in cui i vari componenti siano tutti preassemblati.
- Evitare il più possibile di disconnettere il catetere dalla linea principale.
- Limitare il più possibile l’uso di rubinetti per evitare un aumento del rischio di infezioni; ma preferire i dispositivi dotati di un connettore senza ago integrato.
- Disinfettare le porte dei raccordi, al momento della manipolazione, con clorexidina al 2% o soluzione alcolica. Questa azione non è necessaria se si utilizzano i port protecor.
- Utilizzare i raccordi per l’infusione che siano tra loro compatibili nel punto di connessione, per evitare il rischio di perdite.
- Limitare il numero di lumi a quello strettamente necessario.
- Somministrare farmaci e infusioni compatibili per via periferica, come farmaci non vescicanti, non irritanti, non flebitogeni e soluzioni nutrizionali con osmolarità <800 mOsm/L, pH >5 e <9, come ad esempio Soluzione Glucosata 5% (278 mOsm/L, pH 3.5-6.5), Soluzione Glucosata 10% (555 mOsm/L, pH 5), Soluzione Fisiologica 0,9% (308 mOsm/L, pH 4.5-7).
Gestione dell’accesso vascolare periferico
Le raccomandazioni di base per la corretta gestione di un accesso venoso periferico sono rappresentate dalla gestione appropriata del catetere nel sito di uscita e delle linee infusionali.
La gestione del sito di uscita (exit-site) è focalizzata sulla prevenzione dello spostamento e della contaminazione batterica per via extraluminale. Per le cannule corte, non è necessario alcun cambio di medicazione programmato poiché le medicazioni trasparenti sono studiate per rimanere in posizione per una settimana e pochissime cannule corte resisterebbero così a lungo. L’uso combinato di colla cianoacrilica e medicazione trasparente ridurrà significativamente il verificarsi di cambi di medicazione non programmati. D’altro canto, i cateteri periferici richiedono cambi di medicazione settimanali, la cui procedura include:
- L’igiene delle mani.
- L’uso di guanti non sterili, rispettando la tecnica Aseptic Non-Touch Technique (ANTT).
- La rimozione della vecchia medicazione trasparente e del fissaggio ad adesività cutanea (se presente).
- L’antisepsi cutanea con clorexidina al 2% in alcool isopropilico al 70% (applicazione per 30 secondi lasciando asciugare per altri 30 secondi).
- Il posizionamento di un nuovo sutureless device e di una nuova medicazione trasparente.
Un ruolo importante è svolto dalla sorveglianza e più specificatamente dall’ ispezione visiva periodica del sito di uscita per una individuazione precoce di complicanze locali.
La gestione della linea infusionale è focalizzata sulla prevenzione dell’occlusione del lume e sulla prevenzione della contaminazione batterica per via intraluminale. Le principali strategie, per i dispositivi venosi periferici, per ridurre il rischio di contaminazione e di occlusione del lume sono rappresentate da:
- Utilizzo di connettori senza ago a pressione neutra (NFC).
- Utilizzo di cappucci di disinfezione passiva (port protectors).
- Sostituzione di routine dei set di somministrazione continua non più frequentemente di ogni 96 ore (tranne soluzioni di lipidi esangue e suoi derivati).
- Sostituzione dei set di somministrazione per sangue e derivati alla fine di ogni unità o ogni quattro ore.
- Lavaggio con 2-5 ml di soluzione fisiologica prima e dopo ogni infusione.
- Lock dei dispositivi di accesso venoso periferico, se utilizzati in modo intermittente, solo con soluzione fisiologica.
- Utilizzo di prolunghe ad una o più vie con esiguo priming volume, ricordandosi che bisogna impiegare il minor numero possibile di extension-set e prolunghe, per ridurre il rischio di contaminazione ed infezione.
- Utilizzo di dispositivi dotati di filtri in linea che consentono di rimuovere la contaminazione particellare, microbiologica e aria dalle soluzioni infusionali.
Filtri in linea in prossimità del paziente
È possibile ridurre il rischio di contaminazione da particolato attuando particolari accorgimenti come:
- Scegliere e usare prodotti di qualità.
- Optare per le fiale in plastica, che hanno un basso carico particellare intrinseco, piuttosto che per le fiale in vetro.
- Prestare attenzione alla compatibilità nella somministrazione simultanea di farmaci iniettabili, per evitare una dissoluzione incompleta di uno dei due farmaci e ridurre, così, il rischio di formazione di precipitato.
- Utilizzare aghi con filtro per prelevare i medicinali dalle fiale di vetro prima della somministrazione.
- Posizionare i filtri sulla linea endovenosa in prossimità del paziente.
- Considerare filtri in linea appropriati, da 0,22 μm per soluzioni non lipidiche fino a 96 ore e filtri da 1,2 μm per infusioni lipidiche da cambiare ogni 24 ore. Per la somministrazione di sangue ed emoderivati i filtri da utilizzare devono avere un filtraggio da 170-260 μm, mentre per la trasfusione di piastrine possono essere utilizzati set con filtri di ugual diametro di quelli utilizzati per il sangue ma con un priming volume minore.
Gli operatori devono essere consapevoli del fatto che un filtro occluso solleva il sospetto che sia stato utilizzato un filtro non idoneo o che nella miscela sia presente un precipitato o un particolato. Un filtro occluso segnala la necessità anche di rivedere, da parte del medico, la formulazione dei componenti della sacca parenterale per valutare tutte le potenziali cause del problema.
Le evidenze attuali non consento di generalizzare i risultati dell’utilizzo di questi filtri e quindi consigliarli su larga scala a tutte le infusioni, ma sono presenti in letteratura importanti studi che evidenziano che l’impiego di dispositivi da 0,22 μm abbia ridotto l’incidenza di flebiti da cannule periferiche corte in ambito pediatrico, ma non sepsi e mortalità. Si è recentemente dimostrato che i filtri da 1,2 μm possano trattenere la Candida Albicans riducendo il rischio che questo pericoloso patogeno raggiunga il paziente. Alcuni filtri in commercio presentano anche integrati sistemi di eliminazione dell’aria dalla linea infusionale (Air Eliminating System), eliminando il rischio che aria e particelle possano raggiungere la circolazione arteriosa in pazienti con shunt cardiaci e polmonari dx-sx. La riduzione delle particelle di vario tipo (gomma, vetro, polvere, aggregati lipidici, precipitati farmacologici, batteri ed endotossine) e dimensione (5-50 μm) grazie all’utilizzo dei filtri sembra ridurre le complicanze sistemiche dovute alla introduzione di queste sostanze in circolo, sebbene siano necessari ulteriori studi specialmente RCTs per confermare il dato.
Complicanze
Le complicanze e gli errori sono previsti in una certa una percentuale di casi. Seguire una buona pratica, le linee guida, i protocolli e i bundle aiutano a ridurre notevolmente gli errori in sanità e le complicanze che a volte possono essere anche gravi.
Sebbene i dispositivi di accesso venoso periferico (AVP) siano comunemente considerati sicuri se confrontati con i dispositivi di accesso venoso centrale, sono comunque associati a un’elevata incidenza di complicazioni locali minori, che alla fine concorrono tutte allo stesso esito cioè alla rimozione forzata e non programmata del dispositivo. La sua patogenesi è spesso difficile da definire, soprattutto per le cannule corte, poiché le cause del fallimento del posizionamento del catetere includono la flebite o tromboflebite delle vene superficiali, secondaria a contaminazione batterica, danno chimico, danno meccanico, ostruzione locale del flusso sanguigno, dislocazione parziale del catetere infiltrazione o stravaso dell’infuso nei tessuti circostanti e occlusione del lume del catetere. Il quadro clinico in tutte queste situazioni è identico, cioè dolore o dolorabilità locale, gonfiore, rossore, ostruzione del flusso. Inoltre, più di recente, i dispositivi venosi periferici sono stati anche correlati a complicazioni sistemiche più gravi, come le batteriemie.
L’occlusione del lume non è frequente per le cannule corte, ma è una causa frequente di rimozione per i cateteri periferici lunghi. Un’occlusione intraluminale può essere secondaria a precipitati di farmaci o coaguli di sangue mentre un’ostruzione extraluminale della punta è spesso secondaria a trombosi venosa o alla formazione di manicotto fibroblastico.
Le strategie preventive considerano di evitare l’infusione simultanea di farmaci incompatibili, di utilizzare il lavaggio con soluzione salina prima e dopo ogni infusione e l’utilizzo di soluzioni perifericamente compatibili.
Il dislocamento è una causa di rimozione delle cannule corte, rispetto ai mini-midline e i cateteri midline, perché sono inserite frequentemente in aree instabili (dorso della mano, fossa antecubitale, ecc.) e sono in genere fissate solo dalla medicazione trasparente. Nei pazienti pediatrici, vi è un rischio aggiuntivo correlato alla possibile mancanza di collaborazione del paziente. La prevenzione del dislocamento include sia la scelta corretta del sito di puntura che un fissaggio e medicazioni appropriati. Per quanto riguarda il fissaggio e la protezione si raccomanda di utilizzare colla cianoacrilica e membrana trasparente bordata.
I dispositivi vascolari possono causare un’infiammazione della parete venosa e un danno distruttivo dell’integrità endoteliale, cui fa seguito la formazione locale di un trombo e quindi flebiti e trombosi.
Gli stessi fenomeni possono essere provocati anche da una lesione meccanica, da batteri o da sostanze chimiche contenute nella soluzione infusa. La reazione localizzata può essere associata ad una perdita dell’integrità della parete venosa, con conseguente infiltrazione o stravaso. Quindi bisogna fare prevenzione sia della flebite batterica, adoperando le corrette strategie di impianto e medicazione, che della flebite meccanica e chimica utilizzando il dispositivo di accesso venoso di dimensioni minime praticabili compatibilmente con l’infusione richiesta. I cateteri periferici devono essere scelti rispettando, possibilmente, il rapporto catetere/vena di 1:3, utilizzando un’adeguata stabilizzazione (per evitare micromovimenti del catetere) ed evitando di utilizzarli per la somministrazione ripetuta o prolungata di soluzioni non compatibili perifericamente (irritanti chimici, farmaci vescicanti, nutrizione parenterale con osmolalità >850 mOsm/L).
Il rischio infettivo
L’incidenza di infezioni sistemiche e infezioni del flusso sanguigno dovute a dispositivi periferici è piuttosto bassa, probabilmente inferiore a 0,5 episodi/1000 giorni di catetere. L’infezione del sito di ingresso del catetere molto spesso è dovuta ad un’antisepsi inappropriata al momento dell’inserimento. La migliore prevenzione è l’adozione delle strategie descritte in precedenza, oltre ad adottare una rigorosa e continua ispezione visiva del sito anche utilizzando scale di valutazione validate. Secondo gli standard 2021 dell’Infusion Nursing Society, la presenza di rossore o dolorabilità del sito non è una ragione sufficiente per rimuovere il dispositivo, mentre la contemporanea evidenza di rossore e dolorabilità (con o senza altri segni locali come secrezioni, gonfiore, ecc.) è un’indicazione per la rimozione.
Infezioni associate ai dispositivi di accesso venoso (VAD)
Le infezioni rappresentano la complicanza più grave e più pericolosa potenzialmente correlata ai dispositivi di accesso venoso (VAD), per il rischio di invasione di microrganismi all’interno dei tessuti e nel flusso ematico. Ricordiamo che non tutte le infezioni correlate al catetere siano necessariamente associate a batteriemia.
Potrebbe verificarsi un’infezione locale, come l’infezione dell’exit-site, che comunque clinicamente può essere rilevante. Un’infezione del sito può trasformarsi in un’infezione del flusso sanguigno correlata al catetere per cui è fondamentale controllare frequentemente la zona.
La diagnosi viene solitamente effettuata tramite ispezione e palpazione: la presenza simultanea di rossore e dolorabilità del sito di uscita è considerata altamente sospetta per un’infezione locale e la presenza di infezione è certa se vengono rilevati altri segni locali, come secrezioni purulente, gonfiore, perdita di funzionalità del dispositivo. La diagnosi differenziale tra flebite meccanica e flebite chimica è difficile e l’infiammazione di una piccola vena superficiale, indipendentemente dalla causa, può essere associata a trombosi venosa ed edema/infiammazione della parete venosa.
Il trattamento di un’infezione del sito di uscita, sia per i VAD periferici che centrali, consiste sempre nella rimozione del dispositivo.
La prevenzione delle infezioni dell’exit-site, che sono solitamente il risultato di una contaminazione batterica incontrollata della cute attorno al VAD, si basa su strategie volte a ridurre al minimo la contaminazione extraluminale.
Il biofilm e la lock therapy
Non esiste un catetere ‘sterile’ perché poche ore dopo l’inserimento, qualsiasi dispositivo di accesso venoso è già colonizzato. I batteri e i lieviti si attaccano alle pareti interne del catetere producendo una particolare sostanza glicoproteica, contenente anche lipidi e acidi nucleici, chiamata ‘bioflm’, che agisce come una matrice che include e protegge i microrganismi. Il grado di colonizzazione può essere sufficientemente bassa da essere rilevata solo tramite microscopia elettronica, ma una colonizzazione più importante può essere rilevata mediante metodi microbiologici diretti (coltura del catetere dopo la rimozione) o indiretti (coltura del sangue prelevato dal catetere). Una colonizzazione massiccia sarà potenzialmente associata al passaggio di un numero rilevante di microrganismi dal dispositivo nel sangue, potendo causare batteriemia clinicamente rilevabile e infezione del flusso sanguigno correlata al catetere (CRBSI). Sebbene i VAD centrali siano tradizionalmente considerati più a rischio di CRBSI, questa complicanza grave e pericolosa per la vita può verificarsi anche con l’utilizzo di accessi vascolari periferici (AVP). La chiusura di ogni via del catetere (lock) verrà effettuata solo con soluzione fisiologia perché l’eparina potrebbe favorire la creazione di biofilm in caso di ‘heparin lock tecnique’.
L’antibiotic lock therapy (ALT) è una tecnica datata, messa a punto alla fine degli anni ’80, nel tentativo di eliminare o ridurre drasticamente i batteri presenti nel biofilm, che funziona, secondo diversi studi, solo in una percentuale di casi cioè quelli senza infezione sistemica (brividi e febbre durante l’uso del catetere e remissione durante le pause).
Raccomandazioni Gavecelt del 2024 per la prevenzione delle occlusioni del lume degli accessi venosi:
- Eseguire il lavaggio del catetere in modo ‘pulsante’ (push/pause) con soluzione fisiologica (2 volte lo spazio morto) prima e dopo ogni infusione.
- Lavare in modo ‘pulsante’ (push/pause) con soluzione fisiologica (3-4 volte lo spazio morto) dopo la infusione di emoderivati o dopo infusione di lipidi o dopo la infusione di mezzo di contrasto.
- Evitare i ‘cocktail’ di farmaci.
- Utilizzare strategie ‘no-reflux’: evitare il ‘backflow’ alla deconnessione del sistema, utilizzando soltanto NFC a pressione neutra.
Fonti di infezione
Le fonti possibili di infezioni sono rappresentate da:
- Migrazione dei microrganismi dalla cute al sito di inserzione del catetere (via extraluminale), come per esempio per manipolazione non appropriata del catetere.
- Migrazione dei microrganismi dal punto di raccordo del catetere con il set di infusione (via intraluminale), come per esempio dopo manipolazione non ottimale di raccordi e rubinetti.
- Contaminazione dei liquidi di infusione al momento dell’allestimento dei preparati.
- Contaminazioni delle soluzioni da infondere (flaconi lasciati aperti per lungo tempo).
- Migrazioni di microrganismi provenienti da siti lontani di infezioni per via ematogena (esempio sepsi di varia origine e l’infezione del catetere è secondaria).
Prevenzione delle infezioni degli accessi vascolari
La prevenzione delle infezioni dei cateteri vascolari riguarda tutte le fasi di vita del catetere rappresentate da:
- Indicazione e scelta del presidio.
- Impianto corretto.
- Procedura appropriata della medicazione.
- Gestione corretta delle linee infusionali.
- Rimozione del catetere non più necessario.
La corretta gestione del dolore nel neonato
Il neonato ha memoria del dolore e possiede una soglia rispetto ad esso che cresce con l’età gestazionale. È per questo che nelle attività della Terapia Intensiva Neonatale (TIN) il dolore viene rilevato come 5° parametro vitale. Il dolore può causare nel breve termine delle alterazioni dei parametri vitali con l’aumento del fabbisogno di ossigeno, aumento delle resistenze polmonari, rischio di emorragie cerebrali. A lungo termine il dolore può dare effetti negativi sullo sviluppo neuro-comportamentale e comportare alterazione delle risposte al dolore. La rilevazione è di competenza e responsabilità infermieristica ed avviene attraverso l’utilizzo di scale specifiche per l’ambito neonatale e per il prematuro. I dati raccolti sono indispensabili per offrire al piccolo paziente un intervento personalizzato in termini di decisioni clinico-terapeutiche e confrontare le diverse scelte assistenziali. Le scale maggiormente utilizzate nel neonato per il dolore procedurale sono:
- PIPP (Premature Infant Pain): valuta il dolore procedurale e acuto nel neonato pretermine attraverso un punteggio fondato su parametri fisiologici (FC e Sat O2) e comportamentali (corrugamento della fronte, solco naso labiale e strizzamento degli occhi). È utilizzato per misurare il dolore da procedura in neonati d’età gestazionale compresa fra 28 e 36 settimane.
- NIPS (Neonatal Infan Pain Scale). La NIPS è una scala multidimensionale utilizzata nei bambini prematuri e a termine. Essa è costituita da voci relative alle espressioni del viso, al pianto, al respiro, ai movimenti degli arti superiori e inferiori e allo stato di veglia del bambino. La NIPS presenta alcuni limiti come la non valutabilità del pianto nel caso di neonati prematuri intubati e ventilati meccanicamente (in questa situazione non si segnerebbe niente), e la genericità dei descrittori previsti per ciascuna voce.
- DAN (Dolore Acuto Neonatale): valuta il dolore acuto nel neonato a termine e considera i parametri comportamentali.
L’utilizzo sistematico e semplice delle scale aumenta la sensibilità al problema e la capacità di osservazione dell’operatore, consentendo interventi mirati di tipo farmacologico e non solo. Tra i punti di debolezza vi è la necessità della collaborazione di almeno due operatori per l’osservazione di alcuni item.
Gli interventi che si possono considerare per ridurre il dolore procedurale e quindi lo stress in corso di venipuntura includono:
Interventi ambientali. È raccomandato, se non urgente, programmare la procedura ed eseguirla nello stato basale ottimale ossia nella veglia tranquilla. E’ importante il contenimento, la riduzione degli stimoli ambientali fastidiosi come luci e rumori. Porre attenzione anche al mantenimento di un’adeguata temperatura ambientale e corporea del neonato, per limitare il disagio del raffreddamento.
Interventi non farmacologici. È raccomandato fortemente l’uso del saccarosio (concentrazione consigliata 24%) prima e durante l’esecuzione della venipuntura nel neonato a termine e pretermine o del glucosio al 20-33%. Le evidenze scientifiche suggeriscono il suo utilizzo anche nel lattante fino all’anno di età. È possibile utilizzare l’allattamento materno nel neonato a termine in corso di venipuntura. La dose consigliata di sostanza edulcorata è 0,2-0,5 ml (4-10 gtt) nel neonato pretermine e 1-2 ml (20-40 gtt) nel neonato a termine o vicino al termine. È raccomandata la somministrazione della sostanza edulcorata 2 minuti prima dell’esecuzione della venipuntura.
La suzione non nutritiva. Si è dimostrata efficace specialmente nel neonato a termine e vicino al termine. L’effetto di tale metodica è potenziato dall’azione sinergica della sostanza edulcorata. L’efficacia della saturazione sensoriale è stata dimostrata nella puntura da tallone ed è suggerito per analogia il suo utilizzo anche per la venipuntura.
Interventi farmacologici locali. Se è possibile programmare la procedura e non siamo in presenza di un’urgenza, è raccomandato applicare crema EMLA® 0,5-1 g (1ml = 1 g, 1/5 di tubetto da 5 g) per massimo 60 minuti prima del prelievo con un bendaggio occlusivo non aderente alla cute per non provocare dolore al momento di rimuoverlo, segnando l’ora di applicazione sul bendaggio occlusivo, in aggiunta agli interventi non farmacologici. Nel periodo di applicazione controllare ogni 15′ la presenza di reazioni locali (iperemia, arrossamento, aree di vasocostrizione cutanea), che possono verificarsi a causa dell’applicazione dell’anestetico locale. Si ricorda che in Italia l’uso dell’EMLA® è consentito nel neonato a termine, maggiore di 37 settimane, ma nel pretermine, nonostante esistano studi che ne dimostrano l’efficacia e la sicurezza (un eventuale aumento della metaemoglobina è transitorio e non clinicamente significativo) il suo uso è ‘off-label’ (A.I.F.A. Scheda Tecnica del Farmaco). Dagli studi effettuati risultano efficaci anche altri anestetici locali, come la Tetracaina 4%, Ametocaina gel AMETOP®, Lidocaina liposomiale 4%, crema ELA-Max%® 4%, con il vantaggio di ottenere un anestesia locale ad insorgenza più rapida, già dopo 30 minuti dall’applicazione del prodotto, anche se attualmente non vi è ancora la disponibilità di tali preparati in Italia.
Importanza della gestione del sito di emergenza del catetere
La scelta del sito di emergenza (exit-site) cioè la scelta della vena è un momento molto importante perché può condizionare la durata stessa del dispositivo ricordandosi che ci sono aree cutanee ad alto e basso rischio infettivo. Nel neonato, per quanto riguarda gli accessi periferici, si preferisce scegliere vene sul dorso della mano e al malleolo e in seconda istanza al gomito e alla testa. L’obiettivo di una appropriata gestione del sito è quello di minimizzare il rischio di infezioni locali e infezioni catetere-correlate da contaminazione microbica extraluminale, cioè da contaminazione della superficie esterna del catetere, con il rischio di penetrazione attraverso tale via all’interno dell’organismo. La profilassi del sito si ottiene in modo efficace con una appropriata antisepsi cutanea della zona e l’utilizzo di dispositivi atti a stabilizzare il catetere come la colla al cianoacrilato, l’adesivo cutaneo sterile e la medicazione trasparente semipermeabile sterile.
Studi internazionali hanno dimostrato risultati significativi e relativi vantaggi derivanti dall’utilizzo della colla per il fissaggio dei cateteri endovenosi, che una volta applicata consente di:
- Sigillare il sito di inserimento impedendo il movimento e lo spostamento del catetere.
- Evitare la migrazione extraluminale della flora cutanea attraverso l’exit- site.
- Ridurre i rischi di sanguinamento del sito di emergenza.
- Ridurre il tasso di trombosi perché evita il danno endoteliale causato dal movimento di entrata e
uscita del catetere non stabilizzato.
L’adesivo polimerizza in presenza del fluido tissutale portando alla chiusura della ferita in meno di un minuto, con un’elevata resistenza meccanica e può rimanere in sede da 5 a 10 giorni per poi iniziare naturalmente a dissolversi. L’uso della colla non è stato associato ad alcun effetto collaterale ed è risultata, quindi, sicura e facile sia da applicare che da rimuovere e può essere utilizzata con sicurezza sia nei neonati prematuri che nei pazienti sensibili alla clorexidina e, inoltre, consente l’adattamento del catetere a qualsiasi posizione. Le linee-guida INS (Infusion Nursing Society) del 2021 riconoscono la colla di cianoacrilato come standard di cura per il fissaggio dei dispositivi di accesso venoso.
Bundle Operativo per l’impianto e la gestione dell’accesso venoso periferico nel neonato
Il bundle è uno strumento che aiuterebbe a ridurre le complicanze, come quelle infettive. E’ formato da un insieme di poche e semplici ma forti raccomandazioni, supportati da evidenza scientifica, facili da ricordare e mettere in pratica, ma che funziona solo se è applicato consapevolmente da tutti gli operatori, in ogni circostanza su tutti pazienti rispettando ogni suo punto e controllato tramite una checklist, cioè un elenco dettagliato delle fasi per la verifica, in tempo reale, dell’aderenza della procedura al bundle stesso.
Bundle di impianto
I punti del bundle di impianto:
- Rispettare la corretta indicazione clinica all’impianto, creare ambiente sicuro, ridurre stress e dolore al neonato (coinvolgere i genitori).
- Valutare patrimonio venoso (protocollo RaSuVA – Rapid Superficial Vein Assessment) e scelta del dispositivo più appropriato.
- Eseguire l’antisepsi delle mani e avambracci.
- Eseguire, con cautela, l’antisepsi cutanea sul sito di impianto con clorexidina 2% in alcol isopropilico al 70% e rispettare l’Asepetic Non-Touch.
- Inserire la cannula con una angolazione rispetto alla cute di 10-30° con la smussatura dell’ago rivolta verso l’alto (Far ricorso, se a disposizione, alla tecnologia NIR per vene difficili).
- Stabilizzare il dispositivo con colla istoacrilica in cianoacrilato e sutureless devices (SD) ad adesività cutanea (SAC).
- Proteggere il sito con membrana trasparente ad elevata traspirabiltà (3.000 MVTR).
- Raccordare ogni porta (HUB) del catetere con connettori senza ago (Needle Free Connector – NFC) a pressione neutra.
- Proteggere i NFC con tappini contenenti una spugna con disinfettante da sostituire al momento della deconnessione della linea infusionale e ogni 7 gg se non utilizzati.
Bundle di gestione
I punti del bundle di gestione:
- Posizionare filtri antiparticolato sulla linea infusionale in prossimità del cono del catetere.
- Sostituire le linee infusionali subito dopo il termine di trasfusioni di sangue o emoderivati ed entro 96 ore per le altre infusioni. Se si infondono soluzioni lipidiche sostituire il set ogni 24 ore.
- Effettuare il lavaggio del catetere (flush), prima e dopo ogni infusione, con metodo pulsato (push/pause o start & stop) solo con fisiologica, possibilmente preconfezionata sterile, utilizzando una quantità pari a 2 volte lo spazio morto del catetere o 3-4 volte dopo infusione di lipidi, propofol e/o mezzo di contrasto.
- Eseguire lock con soluzione fisiologica, NFC neutro e Port Protector se uso intermittente.
- Sorvegliare più volte al giorno il sito di inserzione utilizzando scale validate di valutazione, come ad esempio Visual Infusion Phlebitis Score (VIP) o Visual Exite-Site (VES).
- Sostituire la medicazione se sono passati 7 giorni, se sporca, bagnata o staccata.
- Rimuovere immediatamente il catetere in caso di complicanza locale o se non più necessario.
L’ispezione dell’exit-site e utilizzo di scale di valutazione
Una strategia integrata per la prevenzione delle complicanze deve includere sia un’appropriata procedura di impianto del catetere sia e soprattutto una procedura standardizzata per la gestione del sito di emergenza (exit-site) e delle linee infusionali.
Tra le strategie atte a ridurre le complicanze riportiamo:
- Sorveglianza registrando l’incidenza delle complicanze.
- Utilizzo di definizioni chiare ed univoche delle complicanze come, per esempio, la definizione diagnostica di infezione catetere correlata e cioè paziente portatore di catetere venoso con segni di SIRS (Sindrome da Risposta Infiammatoria sistemica – Systemic Inflammatory Response Syndrome), senza altre potenziali cause di infezioni, che presenti almeno uno dei seguenti criteri:
- Isolamento dello stesso microrganismo da una emocoltura da vena periferica e dalla punta del catetere oppure da emocoltura da vena periferica e da emocoltura effettuata da catetere con un tempo di positivizzazione di due o più ore per l’emocoltura eseguita dal catetere venoso (Linee guida IDSA 2009).
- Identificazione di un referente medico e infermiere per la registrazione delle complicanze da catetere coinvolgendo gli organismi aziendali deputati alla sorveglianza delle infezioni (Comitato per le Infezioni Ospedaliere, Risk management, ecc…).
- Utilizzo di protocolli, procedure, bundle e checklist.
- Formazione del personale con un adeguato programma anche di simulazione.
- Monitoraggio documentato della sede più volte nella giornata, con l’utilizzo di scale validate di valutazione come la Visual Infusion Phlebitis Score (VIP) o la Visual Exite-Site (VES), per favorire una lettura oggettiva e confrontabile del fenomeno misurato al fine di esprimere una valutazione quali-quantitativa dell’assistenza.
La flebite si manifesta con i seguenti segni e sintomi che vanno attentamente valutati:
- eritema sul sito.
- arrossamento persistente nel punto di inserimento del catetere.
- dolore o bruciore nel sito e per tutta la lunghezza della vena.
- calore sul sito di inserimento.
- edema che può coinvolgere tutto l’arto.
- vena indurita (rigida), rossa.
- cordone venoso palpabile.
- velocità di infusione rallentata.
- temperatura di un grado superiore rispetto ai valori basali (ipertermia locale).
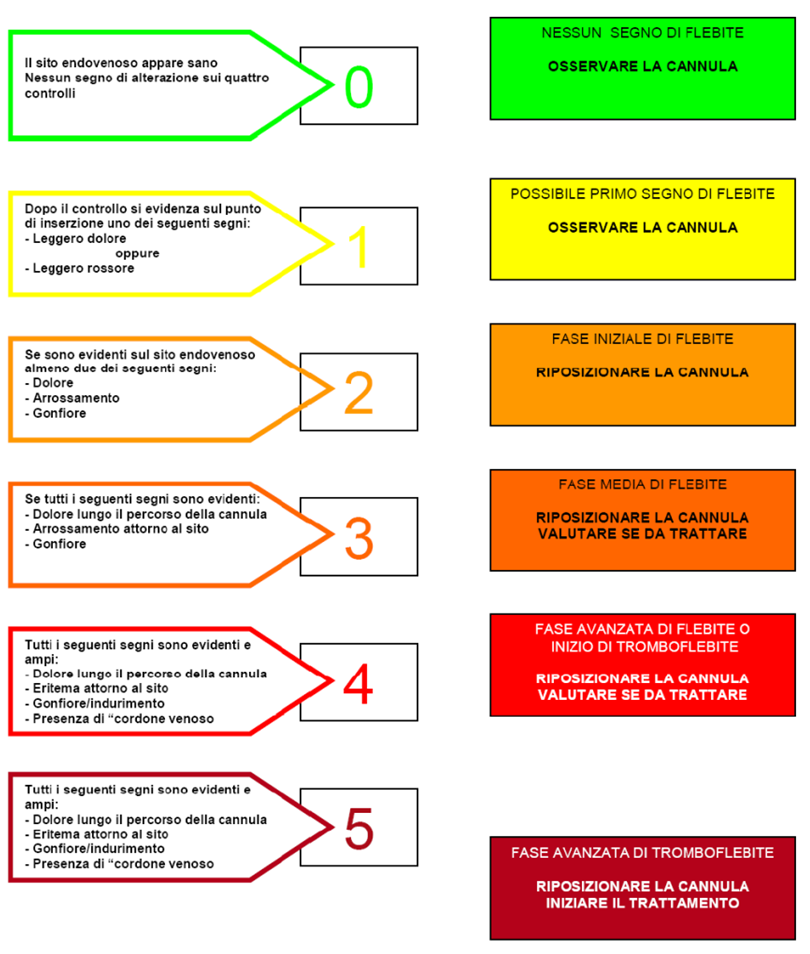
Scala VIP (Visual Infusion Phlebitis score)
La scala VIP prevede uno score da 0 a 5, in ordine crescente di gravità dell’infiammazione. Ogni grado identifica uno stato più o meno avanzato della flebite o della tromboflebite, e si differenzia per l’evidenza di segni specifici e di interventi da adottare.
Score 0: il sito d’inserzione è sano e non vi sono segni di flebite. È indicato solo di proseguire con l’osservazione del dispositivo.
Score 1: si verifica lieve dolore o lieve arrossamento nei pressi del sito di inserzione e questi sono i possibili primi segnali di una flebite. Anche in questo caso bisognerà semplicemente proseguire con il monitoraggio.
Score 2: si verificano due tra i seguenti segni: dolore nel sito di inserzione, arrossamento o gonfiore. È la fase iniziale della flebite, che richiede il riposizionamento del catetere venoso periferico.
Score 3: sono presenti tutti i seguenti segni: dolore lungo il percorso del dispositivo, arrossamento attorno al sito di inserzione e gonfiore. In questo caso siamo allo stadio intermedio della flebite, che impone il riposizionamento del catetere e la valutazione del trattamento.
Score 4: dolore lungo il percorso del dispositivo, arrossamento attorno al sito di inserzione, gonfiore, cordone venoso palpabile sono segni evidenti ed estesi. Siamo allo stato avanzato della flebite o all’inizio di una tromboflebite. Viene raccomandato di riposizionare il catetere e considerare il trattamento.
Score 5: dolore lungo il percorso del dispositivo, arrossamento attorno al sito di inserzione, gonfiore, cordone venoso palpabile, febbre sono segni evidenti ed estesi. Siamo nella fase avanzata di tromboflebite, che richiede di iniziare il trattamento e riposizionare il catetere venoso periferico.
Chiaramente, è importante che rilevazioni e interventi vengano sempre documentati, per un monitoraggio e una prevenzione efficace.
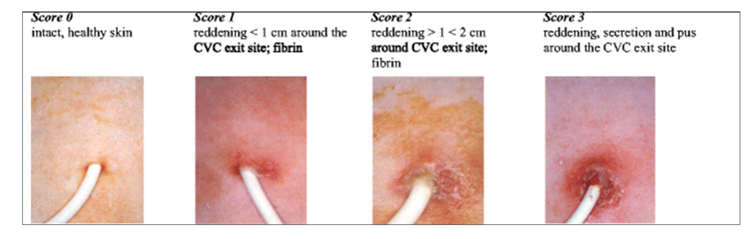
La scala VES indica:
Score 0 in caso di cute sana, integra, senza segni di flogosi.
Score 1 in caso di iperemia all’exit-site inferiore a 1 cm e/o presenza di fibrina.
Score 2 in caso di iperemia all’exit-site superiore a 1 cm e/o presenza di fibrina.
Score 3 in caso di iperemia, secrezione, pus e/o presenza di fibrina.
Considerazioni conclusive
L’accesso venoso periferico prevede il posizionamento e la gestione di un catetere vascolare in una vena periferica, procedura frequentemente utilizzata in neonatologia che, però, non è esente da potenziali complicanze molto spesso prevenibili rispettando una corretta pratica clinica basata su prove di efficacia.
Il bundle con relativa check-list rappresenta un elemento fondamentale nel momento dell’impianto e gestione dei cateteri vascolari sia centrali che periferici, perché favorirebbe la corretta procedura, consentendo la riduzione dei rischi dell’insorgenza delle infezioni e complicanze catetere-correlate. Altri aspetti importanti sono altresì da considerare come:
- L’attuazione sistematica di programmi di formazione e addestramento continuo degli infermieri, con audit finale e refresh a distanza programmata.
- La creazione di programmi aziendali che preveda la sorveglianza, il risk management e l’utilizzo di definizioni chiare e univoche, con la possibilità da parte di ogni Unità Operativa di identificare un referente medico e uno infermieristico per questo aspetto così importante.
- La costituzione di un team medico-infermieristico motivato, formato e, per quanto possibile, dedicato al posizionamento degli accessi vascolari.
- La partecipazione a corsi di formazione e congressi per acquisire maggior competenza (‘know how’).
- La consapevolezza di voler realizzare un cambio culturale, alla cui base devono essere presenti le migliori evidenze scientifiche (EBN), cioè la metodologia che valuti i migliori risultati disponibili in letteratura nel preciso momento in cui si effettua la ricerca scientifica.
- Il controllo del dolore, specialmente nel neonato e nel bambino, attraverso l’adozione sinergica di strategie, presidi specifici, anestetici locali, sedazione e scale di valutazione, ricordando che il posizionamento di una cannula vascolare è considerato una procedura semi-invasiva, che produce stress, dolore e instabilità delle condizioni generali e variazioni dei parametri vitali.
- Il monitoraggio documentato della sede più volte nella giornata, con l’utilizzo di scale validate.
Questi rappresentano elementi fondamentali per guardare il fenomeno da tutti i punti di vista, ottenendo il vantaggio della sicurezza/soddisfazione sia per il bambino e i genitori, sempre al centro dell’attività assistenziale, che per l’operatore, ottenendo così anche il bene dell’azienda sanitaria.
Il ‘take home message’ da proporvi è che la procedura riguardante l’accesso vascolare periferico, che è parte importante ed integrante del processo di cura, deve avvenire secondo evidenze scientifiche aggiornate ed essere sovrapponibile a quella utilizzata per l’impianto e la gestione dei cateteri vascolari centrali.
Fonti bibliografiche
- Bernatchez SF. ‘Care of peripheral venous catheter sites: advantages of transparent film dressings over tape and gauze’ JAVA 2014;19(4):256-61.
- Boussicault G., M. Ollivier, L. Allard, B. Ringuier. ‘Accessi venosi nel neonato, nel lattante e nel bambino’ ECM -Anestesia-Rianimazione 2018; 23(1):1-24.
- D’Andrea V., Pezza L., Barone G., Prontera G., Pittiruti M. & Vento G. ‘Use of cyanoacrylate glue for the sutureless securement of epicutaneo-caval catheters in neonates’. The Journal of Vascular Access 2022;23(5):801-804.
- D’Andrea V., Prontera G., Pezza L., Barone G., Vento G., Pittiruti M., ‘Rapid Superficial Vein Assessment (RaSuVA): A pre-procedural systematic evaluation of superficial veins to optimize venous catheterization in neonates’, The Journal of Vascular Access 2024;25(1):303-307.
- Doellman D., Buckner J.K., Garrett J.H. Jr et al. ‘AVA Pediatrics Special Interest Group. Best practice guidelines in the care and maintenance of pediatric central venous catheters’. Second Edition. USA 2015, pagg. 39-40.
- The children’s hospital at Westmead. GCNC Procedures. Insertion and management of peripheral cannula in neonates. Procedure 2017;1:114.
- Doellman D, Buckner JK, Garrett JH Jr, et al.; AVA Pediatric Special Interest Group. Best prac tice guidelines in the care and maintenance of pe diatric central venous catheters. Second Edition. USA 2015, pagg. 39-40.
- EFCNI, Van Rens R., Helder O. et al., European Standards of Care for Newborn Health: Vascular access. 2018.
- Franceschini G, Talevi G, Gonzalez MS, Bachetti I, Antognini I, Campomori S, Barbarese R, Cartelletti S ‘La corretta gestione del catetere venoso periferico in neonatologia’ M&B Pagine Elettroniche, Novembre 2019 – Volume XXIII, numero 9.
- Gallant P., Schultz A.A. (2006), Evaluation of a visual infusion phlebitis scale for determining appropriate discontinuation of peripheral intravenous catheters, Journal of Infusion Nursing, 29(6): 338-45.
- Gill M., Hirsch A., Wilson N. ‘Filtering Out the Facts: Recommendations to Optimize Performance of In-Line Filters for Parenteral Nutrition and Injectable Lipid Emulsion Infusions. Journal of Infusion Nursing. 2022; 45 (3): 137-141.
- Infusion Nurses Society. Infusion Therapy Standards of Practice. 2024.
- Linee guida per la prevenzione e il trattamento del dolore nel neonato – SIN 2016.
- Linee guida IDSA Practice Guidelines (2009).
- Loveday HP, Wilson JA, Pratt RJ, et al; UK Department of Health. epic3 – National evidence-based guidelines for preventing healthcare associated infections in NHS hospitals in England. J Hosp Infect 2014;86:S1-70.
- Pittiruti M. et al. Raccomandazioni GAVeCeLT 2024.
- WorthingtonP., Gura K.M.; Kraft M.D. et al. ‘ ASPEN PN Safety Committee. Update on the use of filter for parenteral nutrition: an ASPEN position paper. Nutrition in Clinical Practice. 2021; 36 (1): 29-39.











Lascia un commento