La valutazione del microcircolo e dei microparametri in corso di sepsi, in una fase ancora early, può aiutare a riconoscere precocemente una situazione di progressione verso uno stato di shock settico franco e permettere, così, di intervenire nel più breve tempo possibile evitando il verificarsi di questa grave condizione e il rischio di morte per il paziente.
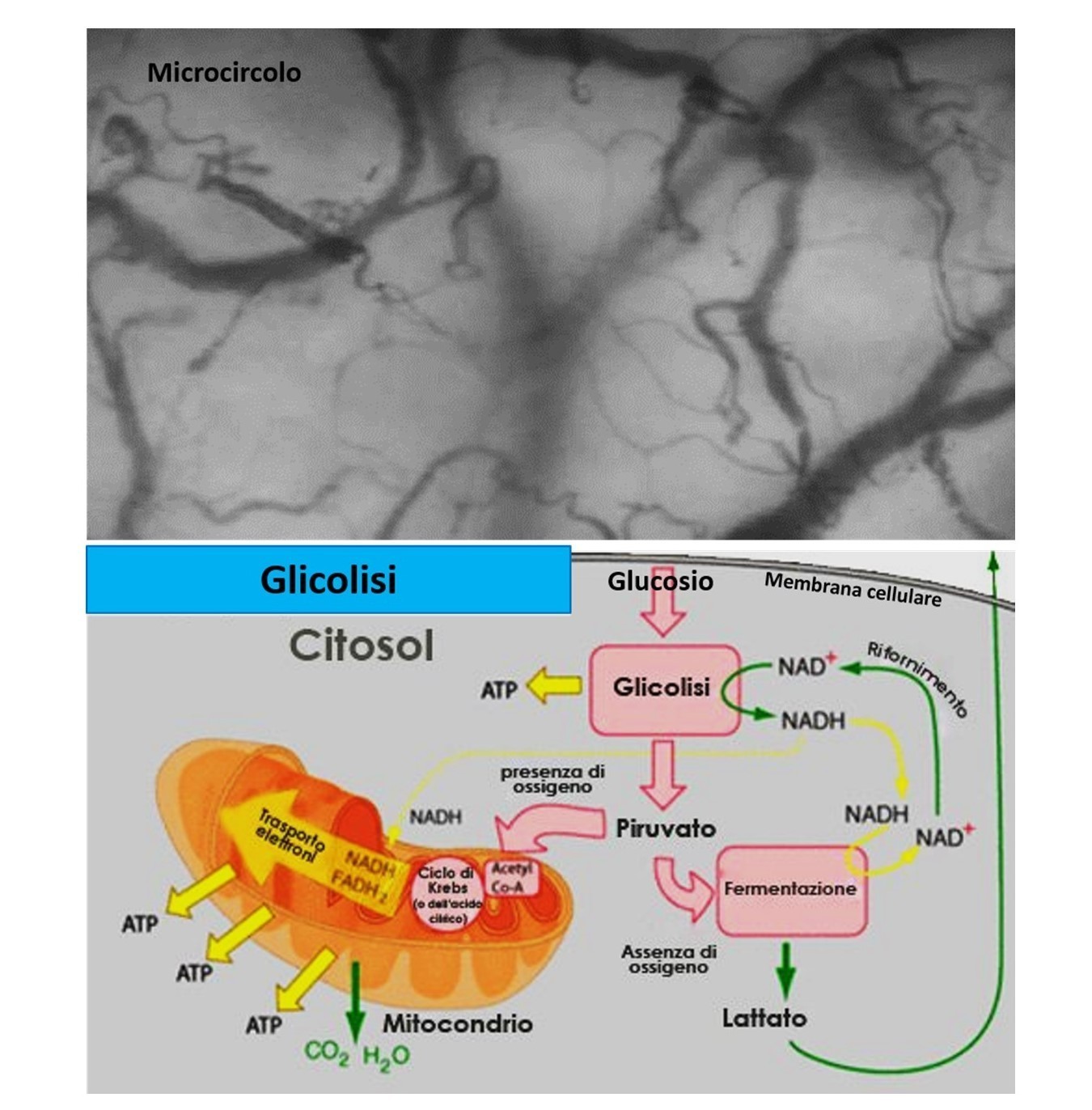
Il sistema microcircolatorio, formato da arteriole, capillari e venule, può essere differenziato in una serie di zone una diversa dall’altra per la tipologia di vasi che presentano nella struttura. Queste zone sono disposte in serie e rappresentano ciascuno una categoria diversa di vasi: arteriole a monte (A), grandi arteriole (LA), piccole arteriole (SA), capillari (CAP), piccole venule (SV), grandi venule (LA), venule a valle (V).
Quindi si formano sette aree o compartimenti al cui interno i vasi sono considerati identici e collegati in parallelo e ciascun sistema a sette compartimenti rappresenta un’unità strutturale che, insieme al tessuto circostante irrorato, viene chiamata `cilindro di Krogh’.
A livello capillare l’O2 si dissocia dall’Hb e diffonde nei tessuti spinto da un gradiente di pressione decrescente a differenza di ciò che accade a livello alveolare dove l’O2 passa rapidamente nel circolo polmonare legandosi poi all’Hb.
La modalità di diffusione dell’O2 nei tessuti è stata teorizzata per la prima volta da Krogh nel 1919 con il suo modello matematico secondo cui ogni capillare è circondato da un certo volume (cilindro) di tessuto perfuso.
Nel modello di Arciero & Secomb solo due compartimenti (LA e SA) dei sette sono attivi, ovvero capaci di vasocostringersi o vasodilatarsi a seconda delle necessità, mentre i restanti vengono considerati tubi rigidi in cui insistono due variabili di stato rappresentate dal diametro del vaso e la capacità che hanno i muscoli, che avvolgono il vaso, di attivarsi permettendo la vasocostrizione/vasodilatazione.
Considerando che i parametri emodinamici, cioè i macroparametri, come la pressione sistolica, possono esprimere una sofferenza tissutale tardivamente è fondamentale quindi andare alla ricerca di microparametri ossia di parametri metabolici, come il pH, la PcvO2 & ScvO2, la DO2/VO2 e O2-demand (DO2 = apporto, VO2 = consumo di O2, O2-demand = domanda), l’estrazione periferica di O2, laPcvCO2,la Pv-aCO2, la concentrazione del lattato e la sua clearance, perché segnali più predittivi. L’emogasanalisi su campione venoso da CVC e quindi prelevato a livello della giunzione cavo-atriale consente di valutare PO2 e PCO2 prima che i valori di questi due parametri vengano influenzati dagli scambi gassosi alveolari rappresentando quindi una espressione della respirazione cellulare e quindi dello stato di ossigenazione e del metabolismo dei tessuti. Il prelievo da CVC è oggi di fatto equiparato al prelievo da catetere in arteria polmonare.
I più importanti microparametri
- PO2 e Sat.O2 da CVC (PcvO2 & ScvO2)
La PO2 normalmente nel sangue venoso centrale (PcvO2) è circa 40 mmHg cui corrisponde una % di saturazione dell’emoglobina (ScvO2) di circa 75%.
La relazione che lega la PO2 alla Sat.O2 nel sangue venoso centrale è lineare a differenza di ciò che accade nel sangue arterioso per cui quest’ultimo parametro è tecnicamente più semplice da acquisire e viene sempre più spesso utilizzato quale indicatore della ossigenazione dei tessuti.
Sebbene la ScvO2 è considerato un indicatore sensibile della globale ossigenazione dei parenchimi, non è tuttavia specifico considerando che la sua riduzione al di sotto del valore di riferimento (circa75%) può essere conseguenza di un ridotto apporto di sangue ossigenato per ridotta gittata cardiaca, anemia, ipossia ma anche di una aumentata richiesta di ossigeno da parte dei tessuti come accade nel caso di tremore, febbre e dolore.
Un valore normale o anche elevato è espressione di una normo o iperossigenazione ma può anche essere legato ad una maldistribuzione del flusso ematico così come accade in alcune forme di shock settico e anafilattico in cui il sangue ossigenato ritorna al circolo venoso saltando i parenchimi.
Comunque anche mancando di specificità la correzione di tale valore se alterato rappresenta un momento fondamentale per ripristinare adeguate condizioni emodinamiche.
2. DO2 e VO2
La DO2 (Delivery di O2) valuta la disponibilità (apporto) di ossigeno che corrisponde alla gittata cardiaca x contenuto arterioso di ossigeno (CaO2). La gittata cardiaca è uguale alla gittata sistolica x frequenza cardiaca mentre la CaO2 è uguale a: (Hb x Sat.O2 x 1,34) + (PaO2 x 0,003).
E’ fondamentale che sia presente una adeguata gittata cardiaca (cardiac output o CO) affinché l’ossigeno contenuto nel sangue arrivi ai tessuti. In condizioni di riposo normalmente la DO2 = 20 ml O2/100 ml di sangue x 5.000 ml/min = 1.000 ml O2/min. Di questi 1.000 ml/min. solo ¼ ossia 250 ml/min. vengono utilizzati in condizioni basali, ciò significa che l’organismo estrae solo il 25% dell’ossigeno disponibile e i caso di necessità attinge da questa riserva aumentando l’estrazione di O2 (OER) però fino ad un punto critico oltre il quale si verifica l’ipossia tissutale. In questa situazione non basta più valutare i parametri arteriosi come la PaO2 e Sat.O2 ma è necessario ricercare gli indici metabolici e spostare l’attenzione sul versante venoso centrale.
La VO2 rappresenta, invece, il consumo di ossigeno che è uguale a GC x (CaO2-CvO2). La CvO2 a sua volta è uguale a: (Hb x ScvO2 x 1,34) + (0,003 x PvO2).
Quando l’apporto di ossigeno (DO2) diminuisce, rimanendo costante il metabolismo, i tessuti inizialmente rispondono aumentando l’estrazione di ossigeno (VO2/DO2). In questo modo il consumo di ossigeno (VO2) resta costante finché l’estrazione non raggiunge un valore massimo. Se la DO2 diminuisce al di sotto del livello critico (DO2 crit.) anche la VO2 diminuisce. Quando si realizza un deficit di ossigeno si avrà un aumento del metabolismo anaerobio e dell’acido lattico e se questa situazione si protrae si potranno avere alterazioni delle pompe ioniche di membrana e danno cellulare.
3. Estrazione periferica di O2 (Oxygen Extraction Ratio: OER)
E’ la % di O2 realmente estratta e quindi utilizzata dai tessuti rispetto all’apporto di ossigeno nel sangue arterioso e si può esprimere come rapporto tra consumo di O2 (VO2) e apporto di O2 (DO2) e cioè OER = VO2/DO2.
Conoscendo il valore di saturazione nel sangue arterioso (Sat.O2) che perfonde i parenchimi e la saturazione del sangue refluo dagli stessi (ScvO2), si può calcolare la percentuale di estrazione tessutale di ossigeno [(Sat.O2-ScvO2)/Sat.O2 x 100].
Il valore normale è 20-25% e rappresenta il meccanismo di compenso utilizzato quando l’apporto di O2 è inadeguato rispetto al fabbisogno. Tanto maggiore è l’OER tanto più basso sarà il valore di ScvO2 ed entrambi i parametri tenderanno a tornare verso i rispettivi valori normali in presenza di un adeguato approccio terapeutico rappresentato dal ripristino della volemia, della capacità di trasporto di ossigeno (per aumento dei valori di emoglobina), dal miglioramento della gittata cardiaca con terapia cardiologica, dal miglioramento della ossigenazione.
Quando l’apporto di O2 (DO2) inizia ad essere insufficiente per il fabbisogno dell’organismo la prima risposta dei tessuti è quella di aumentare l’estrazione di O2 (OER) desaturando il più possibile l’emoglobina del sangue arterioso che li perfonde e riducendo quindi la ScvO2. L’estrazione può aumentare fino a 35-40% e più ma solo per brevi periodi fino ad un DO2 critico, oltre il quale aumentano i prodotti del metabolismo anaerobico. L’OER si calcola semplicemente eseguendo un EGA su sangue venoso centrale e un EGA arterioso.
4. PCO2 nel sangue venoso centrale: PcvCO2
Anche i valori della PCO2 nel sangue venoso centrale (valore normale nei soggetti <45mmHg) riflettono disturbi metabolici e tissutali a differenza di quelli arteriosi che, invece, fanno riferimento alla ventilazione polmonare.
5. Differenza veno-arteriosa di PCO2: Pv-aCO2
Le aree sottoperfuse producono spazzatura metabolica come il lattato ma anche CO2 che diventa CO2 metabolica e si riversa nel versante venoso venendo titolata dal bicarbonato circolante. La differenza di questi parametri tra il versante venoso centrale e quello arterioso dipenderà soprattutto dalla ipoperfusione, cioè dalla velocità con cui questa CO2, prodotta per sofferenza metabolica, arriva ai polmoni per essere eliminata. Qualcuno ha correlato il gradiente veno-arterioso di pCO2 con l’indice cardiaco allo stesso modo di una valutazione invasiva.
L’esecuzione contemporanea di un emogasanalisi arteriosa e da CVC permette di calcolare la differenza di PCO2 tra sangue venoso centrale e sangue arterioso il cui valore normale è 2-4 mmHg.
Questo rappresenta, in pratica, un indicatore fedele e tempestivo della respirazione mitocondriale e il suo monitoraggio è utile anche in condizioni di maldistribuzione del flusso come per esempio durante una sepsi o una reazione anafilattica quando invece l’OER e la ScvO2 presentano valori falsamente tranquillizzanti, perché l’estrazione di O2 in questi casi può essere temporaneamente normale o bassa per incapacità o impossibilità di utilizzo di O2 mentre sussisterebbe una inadeguata respirazione mitocondriale con acidosi ipercapnica venosa.
6. Lattato
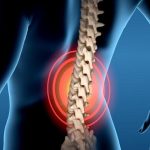
L’energia necessaria per tutti i fenomeni vitali è accumulata come energia chimica nelle molecole di ATP (AdenosinTriFosfato), composto formato da adenina, ribosio e da tre molecole di acido fosforico, sintetizzata a partire dall’ADP (AdenosinDiFosfato) e dal fosfato inorganico. La formazione di ATP avviene nei mitocondri e richiede energia, che deriva soprattutto dall’utilizzo del glucosio. La demolizione completa del glucosio a CO2 e H2O per la sintesi di ATP è un processo che inizia nella matrice citoplasmatica con la glicolisi anaerobia e continua nei mitocondri con la glicolisi aerobia.
La glicolisi aerobia avviene in presenza di ossigeno (respirazione cellulare) e si realizza attraverso tre tappe fondamentali rappresentate da:
- Ciclo di Krebs o dell’acido citrico,
- Sistema di trasporto degli elettroni.
- Fosforilazione.
Tutte queste fasi richiedono la presenza dei seguenti enzimi:
- ossidativi del ciclo di Krebs, che agiscono degradando completamente il glucosio (e i prodotti dell’assorbimento intestinale) per decarbossilazione a CO2 e liberando per deidrogenazione elettroni o equivalenti atomi di idrogeno.
- della catena respiratoria o del sistema di trasporto degli elettroni che trasportano coppie di elettroni o equivalenti atomi di H che alla fine di reazioni intermedie si combinano con l’ossigeno formando acqua e cedendo energia.
- fosforilativi (ATP sintetasi) che determinano la sintesi di ATP. L’energia prodotta viene accumulata nella molecola di ATP e poi utilizzata nei vari processi (sintesi di proteine, polisaccaridi e lipidi, contrazione muscolare, trasporto attivo attraverso le membrane, conduzione dell’impulso elettrico, ecc…) attraverso la riconversione dell’ATP in ADP secondo la seguente reazione ATP à ADP + Pi + E (7.000 calorie).
La prima tappa della degradazione del glucosio non avviene nei mitocondri ma nella matrice citoplasmatica (ialoplasma) e non ha bisogno di ossigeno (glicolisi anaerobia) e gli enzimi interessati in tale processo sono enzimi solubili perché non legati alle membrane. In questa fase il glucosio viene degradato a 2 molecole di acido piruvico (ciclo di Embden-Meyerhof).
Se la fonte energetica è rappresentata dal glicogeno, questo viene inizialmente degradato a glucosio che è poi fosforilato a glucosio-1-fosfato.
L’acido piruvico che si forma in presenza di ossigeno diventa acetato che legandosi al coenzima A forma acetilcoenzima A (Acetil-CoA) e il suo radicale acetato entra nel ciclo di Krebs per essere alla fine ossidato completamente a CO2 e H2O, mentre in assenza di ossigeno è ridotto ad acido lattico.
La trasformazione dell’acido piruvico in acido lattico (fermentazione lattica) si realizza quando per es. l’ossigeno non riesce a raggiungere i tessuti rapidamente in caso di notevoli esercizi fisici e il suo accumulo nei muscoli determina fatica muscolare realizzando il cosiddetto debito di ossigeno.
Durante la glicolisi anaerobia la degradazione di ogni molecola di glucosio richiede 2 molecole di ATP per produrne 4 con un guadagno netto di 2 molecole di ATP. Nel caso della glicolisi aerobia, invece, la produzione totale di molecole di ATP è 36 (2+34) per ogni molecola di glucosio.
L’acido lattico dovrà essere, poi, metabolizzato attraverso il fegato (60%), rene (25%) e altri tessuti. La maggior parte del lattato entra nel ciclo di ‘Cori’ (Carl e Gerty Cori, Nobel per la medicina nel 1947), dove viene riciclato nel fegato che lo trasforma in nuovo glucosio disponibile per le richieste energetiche.
Da quanto descritto si può ottenere una specie di chimica dello shock, come una sorta di adattamento metabolico, tempo-limitata, rappresentata da:
- Blocco della fosforilazione ossidativa.
- Riduzione energetica per diminuzione del rapporto ATP/ADP.
- Riduzione del pH tissutale.
- Aumento dell’acido lattico a causa della glicolisi anaerobia e produzione di sole 2 moli di ATP per 1 mole di glucosio rispetto alle 38 moli di ATP prodotte in presenza di ossigeno (glicolisi aerobia) e quindi con una efficienza energetica ridotta di 1/19.
E’ come se esistesse una finestra temporale entro la quale i tessuti continuerebbero a sopravvivere, però a costi altissimi, grazie a risorse non-O2-dipendenti, producendo un debito metabolico (O2-debt) che andrebbe ripristinato. L’efficacia di questo meccanismo e il ripristino delle funzioni vitali dipenderanno dalle caratteristiche del paziente e dalla tempestività delle misure terapeutiche adoperate.
Un lattato alto con ancora un pH normale è espressione di ipermetabolismo e non ancora di danno tessutale e la prognosi non è ancora grave, mentre un lattato alto e un pH basso significa acidosi lattica. In questo ultimo caso il lattato in 6 ore aumenterebbe più del 10% ma questo arco temporale considerato sarebbe troppo lungo per decidere la terapia da intraprendere.
Si è pensato quindi di osservare la clearance del lattato ad intervalli di tempo con valutazioni seriate ogni 30’-60′ che potrebbe indicarci in maniera determinante l’evoluzione clinica. Clearance lattato = (lattato T₀ – lattato T₁) /lattato T₀ %.
La clearance del lattato è quindi intesa come variazione % della lattatemia iniziale (T₀) in un definito tempo (T₁). Il lattato iniziale tenderà a ridursi progressivamente solo se fegato e reni saranno adeguatamente perfusi e ossigenati. La clearance del lattato si è dimostrata nella clinica un indice prognostico non solo nello shock settico ma anche nelle insufficienze cardio-respiratorie.
Un valore > 10-15% rappresenta un elemento prognostico positivo per l’evoluzione clinica della malattia. In situazioni di normalità il ciclo del lattato, che avviene nel citoplasma cellulare ad opera dell’enzima lattico-deidrogenasi (LDH), è correlato a quello del piruvato, da cui deriva, secondo il seguente rapporto: Lattato/Piruvato < 10:1.
Quindi la lattatemia seriata può essere utile per:
- Definire la gravità della malattia e considerare un trattamento più o meno intensivo.
- Valutare l’impatto della terapia sullo squilibrio DO2/VO2/O2-demand.
- Indicare la presenza di ‘fatica diaframmatica’ come nelle patologie cardio-respiratorie o nel paziente ventilato in cui è presente asincronia ventilatore-paziente.
- Evidenziare la presenza di una ipoperfusione ‘occulta’ a carico dei vari organi, come può accadere nella sepsi e nello shock.
Conclusioni
Fino agli anni duemila i clinici avevano cura solo di ottimizzare i parametri emodinamici, monitorati attraverso il catetere polmonare di Swan-Ganz, prestando attenzione alla pressione arteriosa cruenta e alla gittata cardiaca (con impedenziometria o ecocardiografia), tutte tecniche utili per la gestione del paziente critico ma volte ad investigare solo il versante dell’apporto di ossigeno.
In questo nuovo millennio l’attenzione dei ricercatori si è spostata sul versante tissutale definendo il metabolismo cellulare (microparametri) come vero obiettivo da raggiungere nel più breve tempo possibile.
I microparametri sicuramente possono identificare precocemente un malessere tissutale e svelare condizioni di ipoperfusione occulta in maniera più rapida e attendibile rispetto ai parametri tradizionali, anche se bisognerebbe stare attenti a considerare la possibilità che sussistano limiti interpretativi nei seguenti casi:
- Pazienti (1-2%) che non mostrano mai iperlattatemia per motivi genetici e quindi non sono espressori di lattato appunto per motivi metabolici legati alla loro specifica malattia.
- Situazioni di shunt che portano a concentrare in alcuni organi il lattato o altre metaboliti di sofferenza tissutale esprimendo così valori falsamente normali in circolo.
- Patologie epatiche preesistenti a causa delle quali alcuni metaboliti si presentano già con valori un po’ più elevati.
Anche in questi casi può essere utile la valutazione dei microparametri e considerare la lattatemia seriata rispetto a quella dei macroparametri a volte fuorvianti. La valutazione della clearance del lattato con la creazione di un integrale, per definire la durata temporale durante la quale il paziente è rimasto con il lattato al di sopra del range di normalità, si è dimostrato fortemente predittivo di shock occulto, di ipoperfusione occulta e dell’outcome del paziente in termini di mortalità.
Quindi se la gittata cardiaca potrebbe essere opinabile e la SvCO2 influenzabile da un non utilizzo di ossigeno, come avviene nelle iperossie dovute a incapacità da parte dei tessuti e dei mitocondri di utilizzare ossigeno per diverse cause (shunt, tossine e mediatori chimici), il Δ di lattato seguito nel tempo e il Δ di pCO2 veno-arterioso, invece, sono parametri fortemente predittivi.
La valutazione da considerare, quindi, in corso di sepsi è sicuramente quella rivolta ai microparametri e in particolare al Δ del lattato e al Δ della CO2 senza dimenticare l’aspetto globale, che tenga conto anche della clinica (marezzatura cutanea, stato di coscienza, frequenza respiratoria e frequenza cardiaca) e della valutazione ecografica.
Riferimenti bibliografici
- Bloos F, Reinhart K Venous oximetry. Intensive care medicine (2005), 31(7):911-3.
- Carlson, J.C. Arciero B.E., Secomb T.W. ‘Theoretical model of blood flow autoregulation: roles of myogenic, shear-dependent, and metabolic responses.’ American Journal of Physiology-Heart and Circulatory Physiology 295.4 (2008): H1572-H1579.
- Howell MD, Donnino M, Clardy P et al. Occult hypoperfusion and mortality in patients with suspected infection. Intensive care medicine (2007), 33(11):1892-9.
- Jones A.E., Shapiro N.I., Trzeciak S. et al. ‘Lactate clearance vs central venous oxygen saturation as goal of early sepsis therapy.’ A randomized controlled trial. Jama 2010; 303: 739-746.
- Krogh A.’The number and the distribution of capillaries in muscle with the calculation of the oxygen pressure necessary for supplyng tissue.’ J Physiol (1919), 52:409-515.
- Monesi V. ‘Istologia’ (1985), II edizione Piccin.
- Reinhart K, Kuhn HJ, Hartog C et al. Continuous central venous and pulmonary artery oxygen saturation monitoring in the critically ill. Intensive care medicine (2004), 30(8):1572-8.
- Rivers E., Nguyen B., Havstad S. et al. ‘Early goal-directed therapy in the treatment of severe sepsis and septic shock.’ The New England journal of medicine (2001), 345(19):1368-77.
- Schiraldi F. e Guiotto G. ‘Equilibrio acido-base. Ossigeno. Fluidi & elettroliti’ (2012), Ed. McGraw-Hill Milano.
- Valenza F., Aletti G., Fossali T., Gattinoni L. ‘Lactate as a marker of energy failure in critically ill patients: hypothesis.’Crit Care 2005; 9: 588-593.
Sitografia
‘Una finestra sulla perfusione: l’emogasanalisi da catetere venoso centrale’ visitato il 01/11/2021 http://congress.wooky.it
Immagini dai seguenti link:
Autori
Angelini Gessica, Burdi Maria Teresa, Dentico Domenico, Manzari Raffaele, Pinto Chiara, Quitadamo Maurizio, Tramacere Valentina & Valentini Erika.












Lascia un commento