A cura di
Del Mastro Francesco, Del Mastro Antonio e Lorusso Nicola.
- INTRODUZIONE
La Terapia Parenterale (TP) risulta essere una procedura molto diffusa e praticata dagli infermieri sia nel paziente acuto sia nel paziente cronico ed è frequentemente associata alla necessità di ripetuti controlli ematici.
Le evidenze scientifiche affermano che, oggi, il numero dei pazienti che afferiscono alle cure oncologiche, ematologiche o comunque a terapie infusionali protratte per lunghi periodi è in forte aumento.
La mancanza di una accesso venoso adeguato, comporta: ritardato inizio del piano terapeutico e nutrizionale parenterale; allungamento delle giornate di degenza; aumentate complicanze flebitiche, trombotiche; allungamento dei tempi infermieristici per reperire gli accessi, aumento del disagio e dello stress del paziente.
L’utilizzo del P.I.C.C. ( Peripherally Inserted Central Catheter) ha conosciuto un notevole incremento, essendo considerato un metodo sicuro per la somministrazione a lungo termine di antibiotici, chemioterapici, nutrizione parenterale, sia in ambito ospedaliero che per le cure domiciliari, oltre che di norma ben tollerato dal paziente e di facile inserzione. La presenza di cateteri intravenosi può essere associata a importanti complicanze catetere correlate (TVP, infezione, rottura) e a discomfort per il paziente. Tuttavia, nei pazienti sottoposti a terapie infusionali superiori ai cinque giorni, dovrebbe essere presa in considerazione l’opportunità di fare ricorso ad un catetere intravascolare di media lunga durata, come il PICC, sulla base di criteri di valutazione relativi alle caratteristiche dei farmaci infusi oltre alla disponibilità del letto vascolare periferico, necessario per garantire la continuità terapeutica e l’efficienza del sistema infusivo.
Il Picc può essere inserito da infermieri formati all’inserimento, al riconoscimento e alla gestione di eventuali complicanze, nonché alla medicazione e al follow up dei pazienti.
- COSA SONO I P.I.C.C.
Classificazione ed indicazione all’Impianto
I PICC ( Peripherally Inserted Central Catheters – Catetere Centrale ad Inserzione Periferica) sono dei cateteri venosi centrali ad inserzione periferica costituiti da un tubicino in materiale biocompatibile ( in silicone o in poliuretano) la cui punta raggiunge il terzo inferiore della vena cava superiore. Le dimensioni del diametro esterno sono espresse in French ( 1French = 0,3 mm ), solitamente vengono utilizzati cateteri con French variabile da 3 a 6. Le dimensioni del diametro interno sono espresse in Gauge; la lunghezza è invece espressa in centimetri.
Il PICC è un catetere esterno non tunnellizzato a punta chiusa (Groshong P.I.C.C.) o a punta aperta, ad uno o più lumi, il quale viene classificato, in base al tempo di permanenza, come un catetere venoso centrale a medio termine ( tempo di permanenza da 1 a 3 mesi).
Da circa un paio d’anni alcune case produttrici hanno messo in commercio cateteri venosi centrali per la somministrazione di farmaci con infusori ad alta pressione: si tratta di Port a Cath o PICC chiamati Power. Sono in poliuretano o silicone di ultima generazione, che consente di sopportare pressioni elevate (300 PSI). Infatti la letteratura scientifica consiglia di utilizzare catetere venosi “power” per la somministrazione del mezzo di contrasto ad alte pressioni (es. TAC).
L’impianto di un PICC è indicato:
- per terapie infusionali di medio-lungo termine con durata superiore o uguale a 5 giorni ( Linee guida CDC di Atlanta: categoria II)
- necessità di infusione di soluzioni acide (pH < 5)o basiche (pH >9) o ipertoniche (osmolarità > 800 mOsm/l), o con effetto vescicante o irritante sull’endotelio
- necessità di misurazione della Pressione Venosa Centrale ( P.I.C.C. Power in Poliuretano a punta aperta)
- presenza di alto rischio di complicanze meccaniche qualora si procedesse alla inserzione di un CVC in vena giugulare interna o succlavia (pazienti obesi; pazienti con alterazioni anatomiche e/o patologiche del collo; pazienti con grave coagulopatia);
- presenza di alto rischio di complicanze infettive qualora si posizionasse un CVC tradizionale (pazienti con tracheotomia, pazienti immunodepressi o soggetti ad altorischio di batteriemie);
- situazioni in cui è logisticamente difficoltoso o costoso procedere al posizionamento di un CVC tradizionale (domicilio, mancanza di un team dedicato; etc.);
- necessità di accesso venoso centrale per tempo particolarmente prolungato (‘a medio termine’: < 3 mesi);
- necessità di accesso venoso centrale a medio termine (< 3 mesi) in paziente da trattare anche o esclusivamente in ambito extraospedaliero;
- necessità di accesso venoso centrale a medio termine (< 3 mesi) da utilizzare anche o esclusivamente in modo discontinuo.
Il posizionamento del PICC è controindicato nelle seguenti situazioni:
- Nota o sospetta batteriemia o setticemia
- Pregressa irradiazione del sito di inserimento previsto
- Pregressi episodi di trombosi venosa o interventi di chirurgia vascolare nel sito di posizionamento previsto
- Fattori locali in grado di prevenire l’adeguata stabilizzazione o accesso del dispositivo (eritemi, edemi, eczemi…)
- Insufficienza delle dimensioni corporee del paziente rispetto alle dimensioni del dispositivo impiantato
Tecnica d’ Impianto
L’inserimento di un PICC può essere eseguito da un medico o da un Infermiere adeguatamente formato (Master di primo livello in Accessi Venosi Centrali o Corsi di formazione in Accessi Venosi GAVeCeLT)
Prima dell’inserimento è necessario sempre l’acquisizione di un consenso informato; per quanto concerne l’impianto invece questo va effettuato in un ambiente dedicato. I PICC vengono inseriti attraverso una venipuntura ecoguidata delle vene profonde del braccio (vv.brachiali, v.cefalica, v.basilica), utilizzando la tecnica del micro-introduttore. Il corretto posizionamento della punta del catetere può essere verificato con il metodo dell’ECG intra-cavitario. L’ECG intra-cavitario è un ECG registrato in prossimità della giunzione cavo-atriale. Man mano che l’elettrodo intra-cavitario entra nel terzo medio della vena cava e procede verso l’atrio, l’onda P subisce delle modificazioni:
- Nella vena cava: onda P normale che tende a crescere nel momento in cui il catetere raggiunge il terzo inferiore della vena cava superiore
- Giunzione cavo-atriale: massima altezza dell’onda P;
- Ingresso in atrio dx : onda P inizia a decrescere;
- Atrio dx: onda P bifasica ( positiva-negativa);
La derivazione da utilizzare è DII, in quanto è parallela all’asse di depolarizzazione atriale e garantisce la massima evidenza dell’onda P. Quindi sostituendo l’elettrodo rosso posto sulla clavicola destra con un elettrodo intracavitario che si muove verso l’atrio destro, la derivazione DII leggerà le progressive modificazioni dell’onda P che consentiranno di localizzare la punta dell’elettrodo. La tecnica consiste nel:
- connettere il cavo destinato all’elettrodo rosso all’ago della siringa con fisiologica connessa al lume infusionale del PICC
- infondere fisiologica dalla siringa in modo da far immergere nella stessa l’ago su cui è collegato l’elettrodo rosso
- osservare il tracciato elettrocardiografico sul monitor:
- Quando l’elettrodo intracavitario è distante dall’atrio, l’onda P è normale ;
- Quando l’onda P comincia a crescere, l’elettrodo sta entrando nella vena cava superiore;
- Quando l’onda P raggiunge la massima altezza, l’elettrodo è a livello della giunzione cavo – atriale : la depolarizzazione è ‘di fronte’ all’elettrodo;
- Man mano che l’elettrodo procede dentro l’atrio, compare una incisura negativa prima della onda P, poi l’onda P diviene bifasica (negativa e poi positiva) e poi completamente negativa (quando tutta la depolarizzazione dell’atrio è ‘alle spalle’ dell’elettrodo).
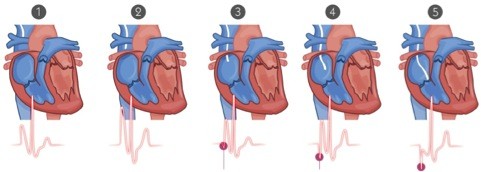
I vantaggi che tale tecnica consente sono notevoli, poiché permette il controllo nel corso della procedura, la ripetitività e la riproducibilità della tecnica anche da altri operatori, la sicurezza del corretto impianto del catetere, la semplicità e la economicità, nonché anche la documentazione attraverso la stampa del tracciato su supporto fisico. L’unica controindicazione al metodo è la difficoltà o l’impossibilità nell’individuare l’onda P sul tracciato elettrocardiografico in paziente affetti da cardiopatie con fibrillazione atriale o pazienti portatori di pace-maker non a demand. In conclusione possiamo definirla come una tecnica altamente attendibile, quanto un RX del torace.
PROCEDURE DI GESTIONE INFERMIERISTICA DEL P.I.C.C.
L’esecuzione di una corretta medicazione e di un’appropriata gestione infermieristica del P.I.C.C. rappresenta uno dei requisiti fondamentali per prevenire complicanze infettive. Le linee guida sulla prevenzione delle infezioni da catetere del CDC di Atlanta (2011) raccomandano un’appropriata igiene delle mani utilizzando acqua e sapone oppure soluzioni gel a base alcolica. L’igiene delle mani deve essere eseguita prima e dopo aver palpato il sito di emergenza del catetere, prima e dopo l’inserzione, la sostituzione, l’accesso, la riparazione e la medicazione del catetere. Dopo aver applicato antisettici la palpazione del sito di emergenza non deve essere eseguita se non con il mantenimento della tecnica asettica. L’utilizzo dei guanti sterili deve avvenire per l’inserimento , in quanto non è possibile l’utilizzo della tecnica “no touch”, e per il cambio della medicazione del sito di emergenza . Una corretta igiene delle mani o con acqua e sapone o con gel a base alcolica per l’impianto, la gestione del PICC e un adeguato protocollo di asepsi per la manipolazione del catetere protegge dalle infezioni.
Medicazione del P.I.C.C.
Subito dopo l’impianto del PICC, la prima medicazione deve essere effettuata con garza e cerotto, da sostituirsi dopo 24h con medesima medicazione se il sito di emergenza presenta sanguinamento o gemizio di siero, o se il paziente suda profusamente. Le medicazioni con garza e cerotto andranno poi sostituite ogni 48h o ogni qualvolta la medicazione risulti sporca, staccata o bagnata, fino alla risoluzione del problema. Se 24h dopo l’impianto l’exit-site non presenta infiltrazioni siero-ematiche, si possono applicare medicazioni trasparenti in poliuretano le quali devono essere sostituite ogni 7 giorni , tranne che nei pazienti pediatrici dove il cambio frequente della medicazione può determinare la dislocazione del catetere. Ad ogni cambio di medicazione bisogna ispezionare accuratamente il sito di emergenza del catetere e palparlo attraverso la medicazione intatta con regolarità, in base alla situazione clinica del paziente. Se il paziente presenta dolore, febbre di origine non chiara, o segni che fanno pensare ad un’infezione locale o ad una batteriemia, è necessario rimuovere la medicazione per effettuare un accurato esame del sito di emergenza. A tal proposito è favorevole l’utilizzo della medicazione trasparente piuttosto che quella con garza e cerotto, perché permette un’ispezione visiva continua del sito di emergenza del catetere. L’exit-site del catetere deve essere disinfettato con clorexidina al 2% in soluzione alcolica prima dell’impianto e per la medicazione del PICC, oppure è possibile utilizzare Iodopovidone al 10%, rispettandone il tempo d’azione che è di due minuti. La disinfezione dell’exit-site deve essere effettuata con tecnica no-touch in 3 passaggi dall’exit-site verso l’esterno. Non utilizzare solventi o pomate antisettiche sul sito di emergenza, poiché il loro utilizzo potrebbe favorire lo sviluppo di infezioni da funghi nonché indurre resistenza a farmaci antimicrobici. Dopo la disinfezione controllare che la misura del catetere al sito di emergenza corrisponda a quella registrata in fase di posizionamento. Per quanto riguarda la medicazione vera e propria sono disponibili attualmente medicazioni avanzate che comprendono il Biopatch e appositi sistemi di fissaggio sutureless ( Statlock, Grip-lok). I biopatch sono dei feltrini a lento rilascio di clorexidina ( antisettico ad ampio spettro efficace contro i batteri e i funghi) da sostituirsi ogni 7 giorni. I dispositivi di fissaggio sutureless permettono da un lato un’ottima stabilizzazione del catetere riducendo pertanto il rischio d’infezioni, dall’altro riduce il rischio di puntura accidentale con ago da satura per l’operatore sanitario.
Per evitare la fuoriuscita accidentale del catetere può essere utile ancorare le vie del sistema infusivo alla cute del malato con un cerotto anallergico.
Non usare pomate o creme antibiotiche nei siti di inserimento (a eccezione dei cateteri di dialisi) perché potrebbero favorire infezioni fungine e resistenze agli antibiotici (livello II).


Lavaggio del catetere
Prima di procedere è necessario sapere quale tipo di catetere è stato impiantato per poterlo gestire al meglio.
Il lavaggio del catetere deve essere effettuato con tecnica pulsante (“ pumping”) a pressione positiva, in cui l’alternanza tra flusso laminare e flusso turbolento rimuove i residui ematici eventualmente presenti nel catetere, riducendo di fatto le possibilità di occlusione del catetere stesso. Per il lavaggio devono essere utilizzate siringhe non inferiori a 10 ml, in quanto siringhe di calibro inferiore potrebbero determinare, data l’eccessiva pressione che esercitano, una rottura del catetere. Eseguire sempre lavaggi pulsanti con due siringhe da 10cc l’una di Soluzione Fisiologica prima di ogni nuova infusione anche in caso di infusioni continue; eseguire la disinfezione dell’Hub prima di connettere nuovi dispositivi infusionali.
Educare eventuale Caregiver e/o familiari all’esecuzione di lavaggi pulsanti con due siringhe da 10cc l’una di Soluzione Fisiologica al termine delle infusioni chiudendo i cateteri in pressione positiva quando si tratta di cateteri a punta aperta.
Riaprire le “Clamps” di chiusura dei dispositivi dopo la de-connessione delle linee infusionali e/o delle siringhe.
Nel caso di infusioni di sacche di sangue o derivati del sangue e/o dopo aver praticato prelievi ematici aumentare la quantità di Soluzione Fisiologica ad almeno 30cc, in siringhe da 10cc l’una, per il lavaggio del catetere.
N.B. Se possibile non utilizzare i dispositivi vascolari per prelievi e/o emotrasfusioni. In presenza di cateteri multilume scegliere una via che rimarrà dedicata all’infusione di sangue, derivati del sangue e/o prelievi.
In caso di cateteri multilume dedicare una via per l’infusione di nutrizioni parenterali ( only P.I.C.C; No Midline)
Lavare i cateteri almeno una volta la settimana anche se non utilizzati. In presenza di dispositivi vascolari multilume è necessario lavare tutti i lumi.
Per i lavaggi: UTILIZZARE SEMPRE SIRINGHE CON CAPACITA’ di 10 ml .
UTILIZZO DI EPARINA
Si consiglia di eparinare i cateteri venosi punta aperta utilizzati in modo discontinuo e tenuti chiusi per periodi >8 ore (per <8 ore è sufficiente il lavaggio con Soluzione Fisiologica), con la sola eccezione dei cateteri a punta chiusa dotati di valvola (Groshong).
Se il catetere a punta aperta rimane chiuso (non utilizzato) per più di 8 ore è necessario: utilizzare due siringhe Luer Lock, di capacità 10cc, la prima riempita con soluzione fisiologica (10cc) ed infondere la soluzione con piccoli boli 1-2cc (lavaggio pulsato),la seconda con Epsodilave 250 U.I./ml, 1cc per Midline, 2cc per PICC ed infondere a flusso laminare chiudendo la Clamp presente sul dispositivo mentre si sta ancora infondendo (chiusura in pressione positiva).
Le raccomandazioni internazionali non suggeriscono di aspirare l’eparina alla riapertura del catetere, in quanto tale farmaco ha un’emivita inferiore alle 6 ore!!
Il volume del lavaggio deve essere uguale al doppio dello spazio morto del catetere e comunque mai inferiore a 5-10 ml.
Se il catetere a punta chiusa (Groshong) rimane chiuso (non utilizzato) per più di 8 ore è necessario:eseguire lavaggio pulsato con 20 ml di sol. fis. Utilizzando 2 siringhe da 10 ml; non utilizzare la tecnica di chiusura del catetere in pressione positiva e non utilizzare Eparina.
La frequenza della eparinizzazione dipende dal tipo di dispositivo (vedere le indicazioni del produttore). In linea generale, più piccolo è il calibro, più frequente deve essere eseguito il lavaggio e l’eparinizzazione.
N.B. Far sempre precedere l’eparinizzazione da un lavaggio “pulsante” con Soluzione Fisiologica.
– Gestione delle linee infusionali
I set di infusione usati in continuo ( compresi rubinetti, connettori etc.) devono essere sostituiti non più frequentemente di ogni 96 ore, ma almeno ogni 7 giorni (categoria IA). I set utilizzati per l’infusione di sangue, emoderivati ed emulsioni lipidiche devono essere sostituiti entro 24h dall’inizio dell’infusione (categoria IB). Se i set sono utilizzati per la somministrazione di Propofol, essi vanno sostituiti ogni 6-12h (categoria IA). I needle-free connectors (NFC) vanno sostituiti non più frequentemente di ogni 72h.
– Prelievo dal PICC
I prelievi ematici dal PICC devono essere effettuati in situazioni di emergenza, in quanto il catetere venoso consente un accesso rapido ad una vena di grosso calibro, o in presenza di un paziente con scarso patrimonio venoso. Fatta eccezione per queste due condizioni, è sempre preferibile effettuare un prelievo ematico da vena periferica, perché il passaggio del sangue attraverso il catetere determina il sedimentarsi di residui ematici che potrebbero non essere rimossi con un lavaggio inadeguato del catetere. La presenza di residui ematici può determinare la formazione di coaguli che possono occludere il lume del catetere; allo stesso tempo gli aggregati fibrinici rappresentano un ambiente ideale per l’impianto e la proliferazione di germi con conseguenti infezioni. La corretta procedura per il prelievo del sangue dal PICC prevede il lavaggio delle mani, l’uso dei DPI e l’utilizzo di una siringa non inferiore ai 10ml connessa al lume del catetere con calibro maggiore per evitare l’emolisi : si aspirano dapprima 5ml che saranno scartati perché considerati sangue di spurgo, successivamente si connette il Vacutainer e si riempiono le provette necessarie, Al termine del prelievo si deve effettuare un lavaggio del catetere con soluzione fisiologica con tecnica pulsante a pressione positiva, in modo tale da eliminare i residui ematici.
Prima di eseguire medicazioni, lavaggi, connessioni e/o deconnessioni ai cateteri vascolari, procedere all’igiene delle mani ed indossare DPI !!
- COMPLICANZE
Le tre principali complicanze correlate ai PICC sono:
– ostruzione del lume del catetere;
– trombosi venosa correlata al PICC;
– sepsi da PICC;
Le cause di un’ostruzione del catetere possono essere distinte in extraluminali ed endoluminali. Cause extraluminali sono rappresentate da un inginocchiamento (kinking) del tratto esterno ( soprattutto con i cateteri in silicone), da una mal posizione della punta del catetere, da una trombosi venosa associata al catetere o dalla formazione di un “ fibrin sleeve”. Cause endoluminali sono l’ostruzione del lume del catetere da coaguli, farmaci, lipidi o mezzi di contrasto. L’occlusione può essere di tipo PWO ( “ persistent withdrawal occlusion”), la quale si manifesta con una difficoltà o impossibilità all’aspirazione senza alcun problema di infusione; oppure vi può essere una sub occlusione con difficoltà all’aspirazione e all’infusione, o un’occlusione completa con impossibilità all’aspirazione e all’infusione. Il trattamento di un’ostruzione del catetere prevede in primo step il lavaggio del catetere con soluzione fisiologica seguito da una disostruzione per mezzo di farmaci, i quali saranno diversi in base alla cause dell’ostruzione. In caso di ostruzione da coaguli si utilizzano trombolitici quali urokinasi ( 5000 UI/ ml in lock per 1-2h, per un massimo di 3 tentativi) o rTPA. In caso di ostruzione da aggregati lipidici è utile la somministrazione di alcol etilico ( 55- 75%, lock 1-2h); se la causa dell’ostruzione è il mezzo di contrasto radiologico si somministra sodio bicarbonato “molare” (8,4%, lock 1h), oppure HCL o NaOH (0,1%, lock1h) se l’ostruzione è determinata da precipitati di farmaci.
La trombosi venosa profonda ( TVP) degli arti superiori rappresenta una delle complicanze associate al PICC, la quale può determinare la necessità di rimuovere l’accesso venoso e aumento del rischio di embolia polmonare. La Tvp si sviluppa entro i primi venti giorni dall’inserzione del Picc e in minima parte oltre il quarantesimo giorno. Nella maggior parte dei casi la TVP correlata al PICC è asintomatica e quindi la vera incidenza di questa complicanza non è nota e le sue cause risultano difficilmente identificabili. L’incidenza della Tvp associata a Picc oscilla tra il 3% e il 38% dei casi; sicuramente una significativa quota di fattori di rischio dipendono dall’Impiantatore: il metodo d’inserzione, la scelta di un catetere di calibro troppo grande per la vena, il mal posizionamento primario della punta del catetere, lesioni traumatiche della parete dovute all’inserimento del PICC sono tutti fattori in grado di determinare una TVP.
A oggi i farmaci non vengono considerati specifici fattori di rischio, anche se l’insorgenza di Tvp è frequente nei pazienti oncologici in chemioterapia. D’altra parte, il cancro stesso è stato riconosciuto come fattore di rischio per la Tvp .
La sepsi da PICC rappresenta una delle complicanze più temute ma prevenibile attraverso una corretta gestione del catetere venoso.. Le linee guida del CDC di Atlanta individuano 4 vie di contaminazione dei cateteri:
1- migrazione di organismi cutanei dal sito di emergenza attraverso il tratto sottocutaneo e lungo la superficie del catetere con colonizzazione della punta del catetere;
2- contaminazione diretta del catetere o del connettore del catetere a causa del contatto con mani, fluidi o dispositivi contaminati;
3- meno frequentemente, i cateteri possono essere infettati da germi provenienti per via ematogena da un’altra sede di infezione;
4- raramente, la contaminazione può avvenire attraverso le soluzioni infusionali;
Le infezioni da PICC possono essere distinte in infezioni locali e sistemiche. Le infezioni locali interessano il sito di emergenza del catetere e si manifestano con dolore, indurimento, calore ed eritema associati a volte alla presenza di un essudato purulento entro 2 cm dal sito di emergenza del catetere. Le infezioni con presenza di iperemia maggiore di 1cm ma inferiore a 2cm all’exit-site, con presenza o meno di fibrina, necessitano l’esecuzione di un tampone cutaneo e la medicazione del sito di emergenza ogni 2-3 giorni disinfettando la cute con clorexidina > 0,5% o iodopovidone al 10%. Se è presente pus, iperemia e secrezione di fibrina, eseguire un tampone cutaneo e medicare ogni 24h, con somministrazione di antibiotico secondo l’antibiogramma. In presenza di manifestazioni cliniche quali febbre superiore ai 38°C, brividi e/o ipotensione, senza fonti apparenti di infezioni, si deve sospettare una infezione sistemica correlata al CVC. In questo caso è necessario eseguire una emocoltura per aerobi ed anaerobi sia da vena periferica che da ogni lume del PICC prima dell’inizio del trattamento antibiotico empirico che prevede la somministrazione di vancomicina; una volta acquisito l’antibiogramma passare alle penicilline semisintetiche. Se il PICC non viene rimosso si effettua una terapia antibiotica sistemica per 10-14 giorni associata ad una “ lock therapy”. In base a numerosi studi, la durata della lock therapy è variabile, ma nella maggior parte dei casi risulta essere di 2 settimane. La “lock therapy”viene attuata attraverso soluzioni che contengono antibiotici (1-5 mg/ml) e 50-100 U di eparina o soluzione fisiologica. Il volume deve essere sufficiente a riempire tutto il lume del catetere e bloccarlo per tutto il periodo di inutilizzo del catetere, per poi essere rimosso prima delle normali infusioni. In caso di persistenza della febbre, positività delle emocolture o in presenza di infezioni recidivanti, il catetere deve essere rimosso. Se il CVC viene rimosso la terapia antibiotica deve essere effettuata per 14 giorni. Strategie per la prevenzione delle infezioni catetere – correlate sono rappresentate dall’educazione del personale sanitario sulle indicazioni dei cateteri intravascolari, sulle procedure corrette per l’impianto e la gestione dei cateteri intravascolari e sulle misure di controllo corrette atte a prevenire le infezioni correlate a catetere intravascolare ( CDC di Atlanta, categoria IA); l’aggiornamento continuo delle conoscenze e l’aderenza alle linee guida di tutto il personale (addestrato e competente) coinvolto nell’impianto e nella gestione del PICC.
Attualmente, esistono in commerci anche cateteri medicati, cioè impregnati di sostanze atte a ridurre il tasso di infezione e/o sepsi.
Gli unici cateteri medicati sicuramente efficaci, secondo le metanalisi e le linee guida correnti, sono quelli ricoperti di clorexidina/sulfadiazina e quelli ricoperti di minociclina/rifampicina.
Nessuno dei cateteri a rilascio di ioni (argento o altro) ha mai dimostrato una reale efficacia negli studi clinici.
Le linee guida SHEA/IDSA 2008 sostengono l’uso nei pazienti adulti di cateteri venosi centrali impregnati di antisettico per esempio clorexidina, sulfadiazina di argento o di antibiotico (per esempio minociclina o rifampicina) perché si riduce il rischio di infezioni (CLABSI Central Line-Associated Blood Stream Infection).
In particolare l’uso di cateteri venosi centrali impregnati di antisettico o antibiotico va considerato in caso di:
– unità ospedaliere o pazienti che hanno alto rischio di CLABSI e che non rispondono alle terapie standard;
– pazienti con accessi venosi limitati e pregressa storia di CLABSI;
– pazienti esposti ad alto rischio di gravi complicanze da CLABSI, per esempio pazienti sottoposti a recenti impianti intravascolari quali valvole cardiache o protesi aortiche.
Nei bambini l’uso di questi cateteri non è raccomandato dalla Food and Drug Administration, perché i dati preliminari suggeriscono che i cateteri impregnati di antibiotico siano sicuri e validi solo nei pazienti pediatrici ricoverati in terapia intensiva.
VANTAGGI DEL PICC:
– Inserzione priva di rischi significativi, fattibile anche in pazienti ‘fragili’ dal punto di vista cardiorespiratorio e/o con gravi problemi coagulativi e/o con trachestomia o altre alterazioni del collo e del torace.
– Inserzione a basso costo
– Bassa incidenza di CRBSI (Catheter-related bloodstream infection )(<1 infezioni/1000 gg catetere), anche nei pazienti immunodepressi o a rischio infettivo .
– Migliore nursing dell’exit site
– Maggior gradimento da parte del paziente
– Il paziente può essere dimesso con il PICC
Le possibili spiegazioni alla bassa incidenza di CRBSI possono essere:
– Lontananza da secrezioni nasali/orali/tracheali
– Bassa contaminazione della cute avambraccio
– Caratteristiche fisiche della cute avambraccio
– Medicazione stabile e pulita
Dati della letteratura ( incidenza CRBSI= numero episodi per 1000gg catetere):
SENZA ECOGUIDA:
1 – 2 /1000 gg (Meta-analisi Maki 2006)
1.07 /1000 gg (Garnacho 2009, in ICU; vs. 3.83
nei CVC)
0.8 /1000 gg (Moreau 2007)
0.6/1000 gg (Ng 1997, pazienti in ICU)
CON ECOGUIDA:
0.4 /1000 gg (Studio prospettico UCSC 2006, pazienti in NP)
0.3 /1000 gg (Studio prospettico UCSC 2010 – Rep. Mal.Infettive)
0 / 1000 gg (Cotogni, 2010 – paz. oncologici in NPD)
0 /1000 gg (Harnage, 2006 – pazienti in terapia domiciliare)
0 /1000 gg (Fearonce 2010 – in pazienti ustionati acuti gravi – vs. 6.6 nei CVC)
Picco CRBSI a 20-22 gg (vs. 10-12 gg nei CVC) (AlRaiy 2010)
ALCUNI “MITI” SFATATI DALLE PIU RECENTI EVIDENZE SCIENTIFICHE:
PICC = alta incidenza di tromboflebiti ?
No, se si utilizza la ecoguida (Simcock 2008, ESPEN 2009)
PICC = bassi flussi ?
No, se si utilizzano PICC ‘power injectable’
PICC = a rischio di occlusione da NP con lipidi
No, se si utilizza una nutripompa
PICC = impossibilità di misurare la PVC ?
No, se si utilizzano PICC in poliuretano a punta aperta
PICC = soltanto monolume ?
No, esistono PICC bilume e trilume (preferibilmente ‘power injectable’)
- Quali sono i vantaggi relativi all’utilizzo del PICC nella somministrazione della terapia endovenosa a lungo termine, rispetto all’utilizzo del CVP ?
Da uno studio ( Evidence Report) condotto da Fumagalli et al. (2010) sulla comparazione tra P.I.C.C. e C.V.P. emerge che nonostante il costo più elevato di quest’ultimo e l’incidenza di complicanze maggiori, il tempo dedicato dagli infermieri alla gestione del P.I.C.C. è inferiore rispetto ai CVP (4,1 h/paziente Vs 5,5 h/paziente).
Inoltre emerge come Il P.I.C.C. è apprezzato dai pazienti (96,8%Vs 79,3%) in quanto consente di ridurre il numero di venipunture necessarie alla continuità della terapia infusionale (1,16, media di venipunture richieste per inserzione del catetere e 0,20, media di punture effettuate per prelievi venosi) rispetto ai CVP (2,27 media di venipunture richieste per inserzione del catetere e 5,98, media di punture effettuate per prelievi venosi) ed il dolore ad esse correlate, oltre che il disagio correlato alla posizione del catetere nel braccio.
La scelta di utilizzare il P.I.C.C rispetto al C.V.P., deve pertanto tenere conto di criteri di valutazione quali: la durata della terapia, la tipologia dei farmaci infusi, le condizioni del patrimonio venoso, i possibili vantaggi per la qualità di vita percepita dal paziente.
- P.I.C.C. O MIDLINE?
Il Midline ha caratteristiche molto simili ma, a differenza del PICC, è un catetere periferico, la sua punta quindi è posizionata a livello della vena ascellare o della vena succlavia comunque in posizione non ‘centrale’. Questo dispositivo, pertanto, non consente gli utilizzi tipici dei cateteri venosi centrali (CVC) “classici” . Rimane pertanto utilizzabile per terapie farmacologiche e nutrizionali compatibili con la via periferica (osmolarità < 800 mOsm/l, pH tra 5 e 9, farmaci non vescicanti e non irritanti per l’endotelio).
Alcuni esempi di indicazione all’impianto:
- qualsiasi trattamento endovenoso previsto per più di 10 giorni, particolarmente nei pazienti con scarso patrimonio venoso periferico
- terapia endovenosa perioperatoria in pazienti con scarso patrimonio venoso periferico (es.: pazienti obesi, o farmacodipendenti, o affetti da patologie croniche)
- terapie antibiotiche prolungate per gravi infezioni (endocarditi, osteomieliti, etc);
- terapie cardiologiche endovenose “salvavita” per periodi prolungati (cardiotonici, cardiocinetici, antiaritmici).
I vantaggi del Midline rispetto ad un ago cannula sono:
- Utilizzo per periodi prolungati (anche per settimane), con bassissimo rischio di complicanze infettive, laddove la durata media di una agocannula venosa tradizionale è di 2-3 giorni.
- utilizzo anche discontinuo, senza che ciò si associ ad una aumentato rischio di ostruzione ( non con Groshong!!!)
- Utilizzo anche in ambito extra-ospedaliero (day hospital, domicilio, hospice).
- Accesso periferico di lunga durata (da 1 settimana a 6 settimane)
- Basso rischio di infezioni batteriemiche (CR BSI): < 0.2/1000gg
- Specifici vantaggi della inserzione ecoguidata:
– Possibilità di inserirli anche nel paziente ‘senza vene’
– Minime complicanze locali.
– Ottimizzazione del lavoro Infermieristico
CONCLUSIONI
Al fine di garantire la continuità della terapia infusionale, anche grazie al risparmio del patrimonio venoso del paziente, l’utilizzo del PICC è consigliato per pazienti con un patrimonio venoso povero, che richiedono un numero elevato di venipunture e che sono sottoposti a terapie che possono provocare Trombosi Venosa Superficiale, responsabile della inefficienza degli approcci venosi periferici.
Nella maggior parte dei paesi europei, in America, Australia, il posizionamento del P.I.C.C o del Midline (e la loro “cultura” ) è ad esclusivo appannaggio degli Infermieri. L’infermiere, pertanto, in qualità di professionista, si assume tutte le responsabilità della manovra; per eventuali danni legati a negligenza imprudenza o imperizia, l’infermiere sarà responsabile legalmente.
Per quanto concerne l’utilizzo dell’ecografo da parte dell’infermiere esso non costituisce alcun impedimento legale poiché non viene utilizzato per finalità diagnostiche , ma come strumento che perfeziona o consente l’attuazione di una certa manovra. (cfr. l’uso del fonendoscopio per assicurarsi del posizionamento intra-gastrico di un sondino per nutrizione enterale).
Tutte le complicanze dell’apposizione di un P.I.C.C. e/o Midline possono essere controllate e trattate a livello infermieristico, e non richiedenti quindi l’intervento di un medico.
In fine si può affermare che la diffusione dei PICC e/o Midline amplia il terreno di competenza infermieristica, semplifica la gestione del patrimonio venoso dei pazienti, riduce i rischi infettivi e le complicanze trombotiche, riduce i costi aziendali.
E’ importante comunque ricordare che :
L’ Infermiere svolge un ruolo fondamentale sia nella gestione che nella informazione ed educazione all’Utente ed ai Familiari.
Va ricordato che è necessario agire con competenza ed appropriatezza:
è quindi fondamentale l’ aggiornamento continuo e adeguato garantendo la sicurezza dell’ assistito.
E io vi dico che la vita è in realtà oscurità,
eccetto dove c’è slancio
Ma qualsiasi slancio è cieco eccetto là dove c’è sapere
E qualsiasi sapere è vano eccetto dove c’è amore
Ma cosa significa lavorare con Amore?
Significa mettere in qualsiasi cosa si faccia
un soffio del proprio Spirito”.
cit. K. Gibran
BIBLIOGRAFIA
- Campisi, C., Biffi, R., Pittiruti, M., and the GAVeCeLT Committee for the Consensus. (2007). Catheter-Related Central Venous Thrombosis. The Development of a Nationwide Consensus Paper in Italy. JAVA;12:38-46.
- Association for Vascular Access. Position Statement on the Use of Real-Time Imaging Modalities for Placement of Central Venous Access Devices. 2008.
- Registered Nurses Association of Ontario.( 2004) Assessment and device selection for vascular access. Nursing Best practice Guideline.
- Centres for Disease Control. Linee guida per la prevenzione delle infezioni associate a catetere intravascolare. Giornale Italiano delle Infezioni Ospedaliere 2002; 9:110-37
- Marschall, J., Mermel, L. A., Classen, D., et al. (2008). Strategies to prevent central line associated bloodstream infections in acute care hospitals. Infection control and Hospital Epidemiology ; 29
- Royal College of Nurses. Standards for infusion therapy, 2010
- National Institute for Clinical Excellence. (2003). Care of patients with central venous catheters.
- Pittirutti, M., Hamilton, H., Biffi, R., et al. (2009). ESPEN Guidelines on Parenteral Nutrition: Central Venous Catheters (access, care, diagnosis and therapy of complications). Journal of Clinical Nutrition; 28:365-77.
- Fumagalli, M.A., Ciani, R., Fabbri, E., Fuzzi, R., Mambelli, T. (2010). Quali sono i vantaggi relativi all’utilizzo del PICC nella somministrazione della terapia endovenosa a lungo termine, rispetto all’utilizzo del CVP? Evidence Report Azienda Unità Sanitaria Locale di Forli- Direzione Infermieristica e Tecnica.’
- Registered Nurses Association Ontario. (2005). Care and manteinance to reduce vascular access complications. Nursing Best Practice Guidelines 2005
- Hamilton, H.C., Foxcroft, D.R. (2007). Central venous access sites for the prevention of venous thrombosis, stenosis and infection in patients requiring long-term intravenous therapy.
- IDSA Guidelines. (2009). Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection”. Update by the Infectious Diseases Society of America .
- PICC Team Aziendale – Azienda Ospedaliera S.Camillo –Forlanini “Appunti per la corretta gestione dei cateteri PICC e Midline”
- Da Ros, L., Ponzo, C. (2011). Gestione del Catetere Venoso Centrale. Quesiti Clinico assistenziali-Dossier. anno 3, n°4, Ed. Zadig (Milano).
- Fumagalli, M.A., Montalti, M., Fuzzi, R., Fabbri, E., Folli, S. (2013). La Trombosi venosa profonda associata al catetere venoso centrale inserito perifericamente (Picc). Rivista “L’infermiere” Ed.n°1 (2013).
- Tomasetti, C., Alfonsi, F., Manna, B., Del Pivo, R., Santini, E., Vitanza, M. Progetto di realizzazione ambulatorio P.I.C.C. e Midline.
- Gillanders, L., Angstmann, K., Ball, P., et al. (2008). AuSPEN clinical practice guideline for home parenteral nutrition patients in Australia and New Zealand. Clinical Nutrition; 24:998-1012.
- Pratt, R.J., Pellowe, C.M., Wilson, J.A., et al. (2007). National Evidence-Based Guidelines for Preventing Healthcare-Associated Infections in NHS Hospitals in England. Journal of Hospital Infection; 65S:S1–S64.
- Mermel, L.A., Allon, M., Bouza, E. ( 2009). Clinical Practice Guidelines for the Diagnosis and Management of Intravascular Catheter-Related Infection. Update by the Infectious Diseases Society of America.Clinical Infectious Diseases, 49: 1 – 45.
- Infusion Nurses Society: Infusion Nursing Standards of Practice. (2011). Journal of Infusion Nursing; 34, suppl. 1: 1-109,Pittiruti, M., La Greca, A., Scoppettuolo, G., Emoli, A., Dolcetti, L. (2007).
- Tecnica di posizionamento ecoguidata dei cateteri PICC e Midline. Nutritional Therapy & Metabolism SINPE NEWS, 1:24-35.
SITOGRAFIA
www.gavecelt.it Ultimo accesso: 14.07.14.
www.piccteam.it Ultimo accesso: 14.07.14.











Lascia un commento