Sono una classe di antibiotici β-lattamici, cioè con struttura ad anello β-lattamico.
La loro struttura chimica contiene il 2,3 diidro-1Hpirrolo. Sono antibiotici ad ampio spettro di attività batterica e molto resistenti alle β-lattamasi. Hanno una struttura molto simile alle penicilline, ma l’atomo di azoto in posizione 1 è stato sostituito con un atomo di carbonio da cui deriva il nome carbapenemi.
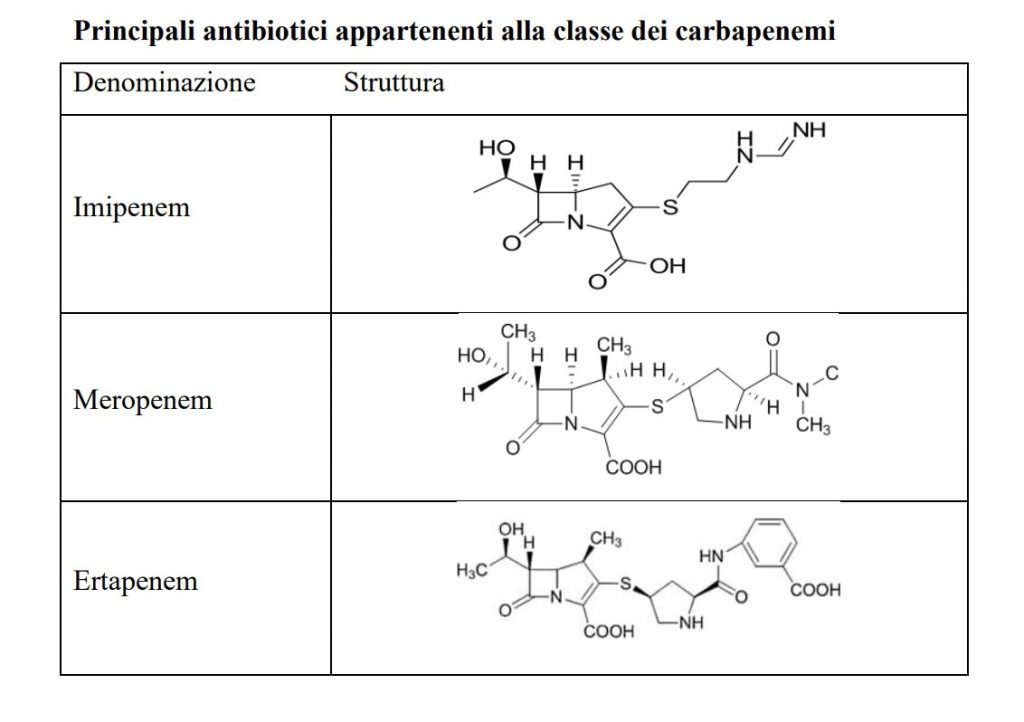
I farmaci appartenenti a questa classe sono Imipenem, Meropenem ed Ertapenem.
In clinica Imipenem è impiegato in associazione con la Cilastatina, un inibitore della deidropeptidasi.
I carbapenemi sono usati per trattare le infezioni causate dalle Enterobacteriaceae multi-farmaco-resistenti.
Sono usati come antibiotici di ultima risorsa per trattare le infezioni dovute a bacilli Gram-negativi multi-resistenti. L’impiego in terapia dei carbapenemi è stato limitato alle infezioni gravi in pazienti che hanno molte possibilità di guarigione per evitare l’insorgenza di resistenze.
Le resistenze ai carbapenemi nei bacilli Gram-negativi limitano le scelte di trattamento per le infezioni che minacciano la sopravvivenza del paziente.
La formula di struttura degli antibiotici carbapenemici è stata sviluppata originariamente dalla Tienamicina, un prodotto naturale derivato dallo Streptomyces cattleya.
Essi sono distinti in tre gruppi in base al loro spettro d’azione:
1. Carbapenemi con spettro d’azione più ristretto, ovvero senza attività su Gram-negativi non fermentanti e Staphylococcus aureus resistente alla meticillina (MRSA), come Ertapenem.
2. Carbapenemi “classici” che hanno attività elettiva nei confronti dei non fermentanti tra questi Imipenem e Meropenem.
3. Carbapenemici con attività sia su MRSA sia sui non fermentanti.
Imipenem
È un derivato ammidinico della Tienamicina e ha un ampio spettro d’azione antibatterica, essendo attivo su germi aerobi e anaerobi Gram-positivi e Gramnegativi. È attivo anche nei confronti dei Gram-negativi quali Enterobacteriaceae (anche quelle che producono ESBL), ma anche verso Pseudomonas sp. e Acinetobacter sp.
Il farmaco è metabolizzato maggiormente a livello renale, idrolizzato dalla deidropeptidasi I o DHP, una β-lattamasi localizzata a livello dei microvilli dell’orlo a spazzola dei tubuli prossimali che agisce aprendo l’anello βlattamico.
Esso è impiegato in clinica in associazione alla Cilastatina, la quale è priva di attività antibatterica e della capacità di inibizione delle β-lattamasi batteriche.
L’associazione di queste due sostanze permette di avere concentrazioni urinarie dell’antibiotico molto elevate.
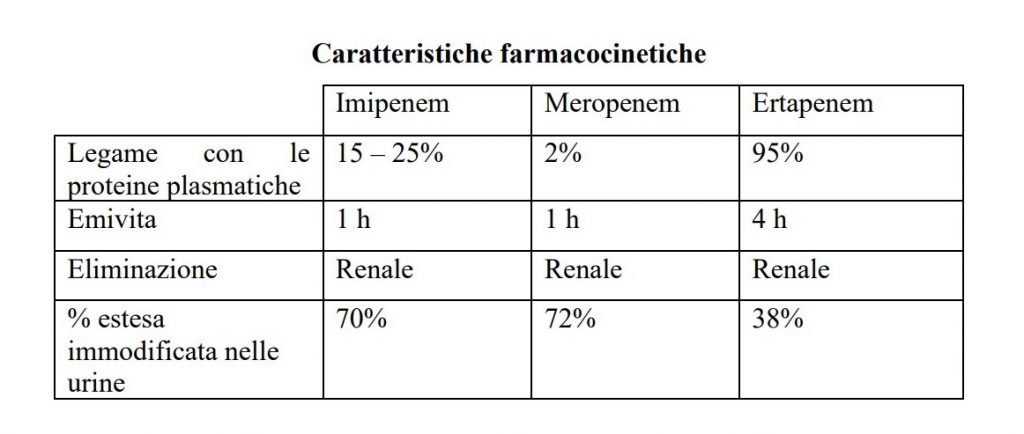
Imipenem si lega alle sieroproteine in percentuale minore rispetto alla cilastatina e in caso di meningite entrambi passano nel liquor.
Attualmente diversi Gram-negativi difficili, in particolare Pseudomonas aeruginosa e Acinetobacter baumannii sono resistenti a questo antibiotico.
Meropenem
È un derivato carbapenemico semisintetico che differisce dalla Tienamicina e dall’Imipenem per la maggiore stabilità nei confronti delle deidropeptidasi, in particolare dalla deidropeptidasi I umana, per la presenza di un gruppo metilico in posizione C1.
Presenta uno spettro d’azione molto ampio con un’attività in particolare antibatterica superiore a quella dello stesso Imipenem nei confronti di molti Gram-negativi aerobi come Haemophilus influenzae, Neisseria Gonorrhoeae e quasi tutte le Enterobacteriaceaea che producono ESBL, ma ha attività minore nei confronti di molti Gram-positivi, soprattutto Streptococchi e Stafilococchi.
È meglio tollerato rispetto a Imipenem e per questo può essere somministrato anche in gravidanza. Rispetto a Imipenem ha un legame farmaco-proteico minore e anche scarsa penetrazione liquorale in caso di meningi infiammate.
È il farmaco di scelta nella terapia delle infezioni nosocomiali, nonostante si siano riscontrati ceppi resistenti.
Ertapenem
Questo antibiotico è un derivato carbapenemico simile a Meropenem, stabile nei confronti della deidropeptidasi I umana. Può essere utilizzato senza l’associazione con Cilastatina, (inibitore enzimatico).
Presenta un elevatissimo legame farmacoproteico (95%) ma una bassa distribuzione tissutale. È metabolizzato a livello renale e non epatico ed eliminato dal rene.
È un farmaco ad ampio spettro ma ha un’attività marginale nei confronti dei Gram-negativi non fermentanti come Pseudomonas aeruginosa, è attivo nei confronti dei batteri anaerobi e delle Enterobacteriaceae che producono ESBL.
CARBAPENEMASI
Le carbapenemasi o enzimi idrolizzanti i carbapenemi, sono enzimi che costituiscono la più versatile famiglia di β-lattamasi, appartenenti alle classi molecolari A, B ed E, con capacità di idrolizzare le penicilline, le cefalosporine, i monobattami e i carbapenemi.
Sebbene siano conosciuti come “carbapenemasi” molti di questi enzimi riconoscono in concreto tutti i β-lattamasi idrolizzabili e la maggior parte di questi sono resistenti verso l’azione di tutti gli inibitori delle βlattamasi disponibili in commercio.
Le carbapenemasi sono state scoperte nel 1996 grazie al primo isolato di batterio (KPC) Klebsiella pneumoniae Carbapenemasi che è stato ottenuto da un campione clinico di Klebsiella pneumoniae, in un ospedale del North Carolina incluso nel programma di sorveglianza sull’epidemiologia delle resistenze nelle strutture di terapia intensiva (ICARE).
Nel 2001 è stato descritto un nuovo fenotipo di resistenza dovuto all’espressione di una nuova carbapenemasi di tipo KPC-1 e da allora sono state descritte diverse varianti di “Klebsiella pneumoniae carbapenemases”.
Gli organismi produttori di carbapenemasi continuano ad aumentare e si diffondono velocemente: inizialmente la maggior parte delle carbapenemasi è stata trovata in isolati di Escherichia colii e Klebsiella pnuemoniae, attualmente è presente anche in altri generi della famiglia delle Enterobacteriaceae come Proteus sp, Serratia sp, Salmonella sp, Citrobacter sp. Le carbapenemasi sono capaci di idrolizzare tutti i beta-lattami.
Quelli di classe A sono enzimi in grado di idrolizzare tutte le penicilline, le cefalosporine e i carbapenemi, sono codificate dal gene blaKPC localizzato approssimativamente su 85kb di un plasmide coniugativo (98,99).
Quelli della classe B sono designate come metallo-β-lattamasi (MBL) per la loro dipendenza dallo zinco della loro attività idrolitica, e includono le carbapenemasi IMO, GIM, SIM, SPM e VIM, spesso descritte in Pseudomonas aeruginosa e in altri patogeni multi-resistenti.
Il problema delle resistenze mediata dalla carbapenemasi è aumentato quando i geni di questi enzimi si sono associati con determinanti genetici acquisiti. La trasmissione dei geni per le carbapenemasi avviene quando il gene è allocato all’interno di elementi mobili, quali plasmidi, trasposomi e integroni (56,57).
Si ipotizza che la trasmissione dei geni per le carbapenemasi proceda in due direzioni: le sorgenti ambientali potrebbero fornire il materiale genetico codificante questi enzimi e i ceppi clinici potrebbero disperdere queste informazioni nell’ambiente circostante e nelle strutture ospedaliere.
Le carbapenemasi sono più frequenti nelle specie Enterobacteriaceae fermentanti il lattosio ad esempio Klebsiella pneumoniae ed Escherichia colii piuttosto che nelle Enterobacteriaceae non fermentanti, come ad esempio Serratia marcescens e alcune altre Enterobacteriaceae spp e nelle specie Pseudomonas aeruginosa.

I meccanismi, che intervengono sinergicamente nella cellula batterica e contribuiscono a determinare la resistenza al farmaco, dipendono dal fatto che il plasmide contiene i geni dell’antibiotico-resistenza e codifica per le pompe di efflusso e per enzimi inattivanti l’antibiotico per degradazione o per alterazione della struttura.
L’antibiotico che entra nella cellula batterica viene in parte espulso tramite le pompe di efflusso, in parte degradato o alterato, quindi, modificato nella sua struttura e reso inattivo.
Anna CATACCHIO
Ultimi articoli pubblicati
- Via libera alle tre lauree magistrali infermieristiche: svolta storica
- Il piccolo Domenico è morto
- Prescrizione infermieristica, stop dei medici: scontro sul decreto MUR
- Giornata nazionale Covid: Nursing Up denuncia 175.000 infermieri mancanti e rischio per la sanità
- Corso Ecm (16 crediti) Fad gratuito per infermieri: “L’impatto dei prodotti fitosanitari sull’ambiente e sulla salute umana – Seconda edizione”














Lascia un commento