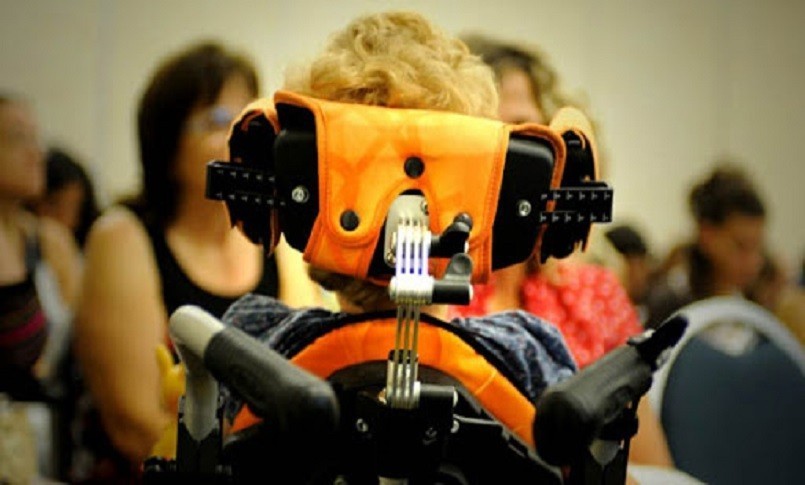
L’atrofia muscolare spinale è la maggior causa genetica di mortalità infantile.
Il Comitato per i medicinali per uso umano (Chmp) dell’Agenzia Europea del Farmaco (Ema) ha raccomandato l’approvazione di risdiplam (Evrysdi) di Roche per il trattamento dell’atrofia muscolare spinale 5q (Sma) in pazienti di età pari o superiore a due mesi, con diagnosi clinica di Sma di tipo 1, tipo 2 o tipo 3, o con da una a quattro copie di Smn2.
La Sma è la maggior causa genetica di mortalità infantile e la Sma 5q è la forma più comune della malattia. Causa progressiva debolezza e atrofia muscolare, e molte sono le esigenze non ancora soddisfatte, specialmente per gli adulti che convivono con questa malattia. La raccomandazione del Chmp è stata completata tramite la procedura accelerata di valutazione, che viene accordata ai farmaci che vengono considerati di maggiore rilevanza per la salute pubblica e l’innovazione terapeutica. Una decisione definitiva sull’approvazione è attesa entro i prossimi due mesi e sarà applicabile a tutti gli stati membri dell’Unione Europea, nonché a Islanda, Norvegia e Liechtenstein. Evrysdi è stato approvato dalla Food and Drug Administration (Fda) degli Stati Uniti nell’agosto 2020.
“Grazie alla nostra stretta collaborazione con la comunità Sma abbiamo sviluppato il primo trattamento a domicilio per la Sma in neonati, bambini e adulti con diversi livelli di gravità della malattia, la maggior parte dei quali rimane non trattata – ha dichiarato Levi Garraway, direttore sanitario e capo del Product Development di Roche –. Se approvato, Evrysdi rappresenterebbe un’opzione terapeutica importante e necessaria e ci aspettiamo che diventi il trattamento di scelta per le persone che vivono con la SMA e le loro famiglie”.
“Siamo felici di essere al fianco della comunità della Sma e poter offrire un’ulteriore speranza a questi pazienti – afferma Alessandra Ghirardini, Roche Neuroscience and Rare Diseases Medical Lead -. In Italia 118 di loro hanno già potuto beneficiare del farmaco in quanto arruolati nei nostri studi clinici e abbiamo dato l’opportunità ad altri 140 pazienti, che al momento non avevano alternative teraputiche adatte a loro, di ricevere già il nostro farmaco all’interno di programmi di uso compassionevole”.
La raccomandazione del Chmp è basata sui dati raccolti in due studi clinici progettati per dare rappresentatività ad un ampio spettro di pazienti che convivono con la Sma: Firefish nei neonati sintomatici di tipo 1 dai due ai sette mesi e Sunfish nei bambini e negli adulti sintomatici di tipo 2 e 3 dai due ai 25 anni.
Sunfish è il primo e unico studio controllato con placebo che include gli adulti con Sma di tipo 2 e 3. In Firefish il 29% (12/41; p<0.0001 rispetto al decorso naturale) dei neonati sottoposti a terapia con Evrysdi ai 12 mesi erano in grado di sedersi senza supporti per almeno cinque secondi, come definito nella Gross Motor Scale della terza edizione delle Bayley Scales of Infant and Toddler Development. Questo rappresenta una pietra miliare fondamentale mai raggiunta nel decorso naturale della Sma di tipo 1.
Inoltre il 93% dei neonati è sopravvissuto e l’85% non ha avuto episodi (senza ventilazione artificiale). Per di più il 5% (2/41) dei neonati era in grado di stare in piedi senza supporti, come definito nella Hammersmith Infant Neurological Examination, e l’83% era in grado di nutrirsi per via orale. Il novanta percento (37/41) ha ottenuto un punteggio Chop-Intend di almeno 4 punti, mentre il 56% (23/41) ha ottenuto un punteggio superiore a 40; l’incremento medio è stato di 20 punti.
L’età media al reclutamento era di 5.3 mesi. Un farmaco liquido, Evrysdi viene somministrato giornalmente a domicilio per via orale o mediante sonda gastrica. In Sunfish, i bambini e gli adulti sottoposti a terapia con Evrysdi hanno riscontrato un miglioramento clinicamente significativo e statisticamente rilevante nella funzione motoria ai 12 mesi (1.55 punti di differenza media; p=0.0156) rispetto ai pazienti sottoposti a placebo (1.36 punti [95% CI: 0.61, 2.11]; -0.19 punti [95% CI: -1.22, 0.84], rispettivamente), come definito dalla variazione del punteggio totale nella Motor Function Measure-32 (MFM-32).
I bambini e gli adulti hanno anche riscontrato un miglioramento significativo nella funzione degli arti superiori, un importante obbiettivo secondario, ai 12 mesi (1.59 punti di differenza media; p=0.0469) rispetto ai pazienti sottoposti a placebo (1.61 punti [95% CI: 1.00, 2.22]; 0.02 punti [95% CI: -0.83, 0.87] rispettivamente), come definito dalla variazione nel Revised Upper Limb Module (RULM). L’età media al reclutamento era di nove anni. Evrysdi ha dimostrato di avere un profilo favorevole dal punto di vista dell’efficacia e della sicurezza, con il profilo di sicurezza stabilito nei trial Firefishe Sunfish.
Le più comuni controindicazioni sono state infezioni delle vie respiratorie superiori, polmonite, naso-faringite, piressia, stitichezza, rinite, diarrea, emicrania, tosse e vomito. Non ci sono stati risultati avversi correlati alla terapia che hanno portato al ritiro in nessuno dei due studi. Evrysdi è stato ideato per curare la Sma incrementando e sostenendo la produzione della proteina survival motor neuron (Smn).
La proteina Smn è presente in tutto il corpo ed è essenziale per preservare la salute dei motoneuroni e del movimento. Più di 2.500 pazienti sono stati sottoposti a terapia con Evrysdi tra trial clinici, uso compassionevole e contesti reali, con pazienti dalla nascita fino a oltre i 70 anni, inclusi quelli precedentemente curati con altre terapie contro la Sma. Roche ha guidato lo sviluppo clinico di Evrysdi come parte di una collaborazione con la Fondazione Sma e PTC Therapeutics.
Roche è attivamente coinvolta con gli organismi di rimborso e valutazione dei Paesi europei per assicurare un ampio e rapido accesso ai pazienti che ne hanno bisogno. Diverse pratiche di rimborso sono state presentate in molti paesi in vista della decisione prevista della Commissione europea per minimizzare ritardi nell’accesso al paziente.
Risdiplam (Evrysdi)? – Evrysdi è un modificatore dello splice del survival motor neuron 2 (SMN2) ideato per curare la Sma causata dalle mutazioni del cromosoma 5q che portano ad una carenza dalla proteina Smn. Evrysdi viene somministrato giornalmente a domicilio in forma liquida per via orale o mediante sonda gastrica. Evrysdi è stato approvato in sette paesi (Stati Uniti, Cile, Brasile, Ucraina, Corea del Sud, Georgia e Russia) ed è stato presentato in altri 57. Evrysdi è stato sottoposto a valutazione in quattro trial multi-centro su persone con Sma:
- Firefish (NCT02913482) – uno studio clinico pivotal a due fasi e aperto, per i neonati con Sma di tipo 1. La prima parte consisteva in uno studio di aumento della dose in 21 neonati, con l’obbiettivo principale di valutare il profilo di sicurezza di risdiplam nei neonati e stabilire la dose per la seconda parte. La seconda parte consiste in uno studio pivotal a braccio singolo di risdiplam su 41 neonati con Sma di tipo 1 curati per due anni, seguito da un’estensione aperta. Il reclutamento per la seconda parte è stato completato nel novembre 2018. L’obbiettivo principale della seconda parte era quello di valutare l’efficacia misurata con la proporzione dei neonati che si siedono senza supporti dopo 12 mesi di cura, come previsto dalla terza edizione della Gross Motor Scale delle Bayley Scales of Infant and Toddler Development (BSID-III) (definita come sedersi senza supporti per 5 secondi). Lo studio ha raggiunto il suo obbiettivo principale.
- Sunfish (NCT02908685) – Sunfish è uno studio pivotal in due fasi condotto a doppio cieco e controllato con placebo su persone tra i 2 e i 25 anni con Sma di tipo 2 o 3. La prima parte (n=51) ha determinato la dose per la seconda parte. La seconda parte (n=180) ha valutato la funzione motoria usando il punteggio totale della Motor Function Measure 32 (MFM-32) ai 12 mesi. MFM-32 è un test convalidato usato per valutare le abilità fino- e grosso-motorie nelle persone affette da malattie neurologiche, inclusa la Sma. Lo studio ha raggiunto il suo obbiettivo principale.
- Jewelfish (NCT03032172) – Uno studio esplorativo aperto ideato per accertare la sicurezza, tollerabilità, farmacocinetica e farmacodinamica nelle persone con Sma tra i 6 e i 60 anni che hanno ricevuto altre terapie sperimentali o approvate per la Sma per almeno 90 giorni prima di ricevere Evrysdi. Lo studio ha completato il reclutamento (n=174).
- Rainbowfish (NCT03779334) – Uno studio multi-centro aperto a braccio singolo che studia l’efficacia, sicurezza, farmacocinetica e farmacodinamica di risdiplam nei neonati (~n=25), dalla nascita fino alle 6 settimane (alla prima dose) con Sma diagnosticata geneticamente che non presentano ancora sintomi. Il reclutamento è attualmente aperto.
La Sma – La Sma è una grave malattia neuromuscolare degenerativa che può essere fatale. Colpisce approssimativamente un bambino ogni 10mila ed è la maggior causa genetica di mortalità infantile. La Sma è causata da una mutazione del gene survival motor neuron 1 (Smn1), che comporta una carenza della proteina Smn. Questa proteina si trova in tutto il corpo ed è essenziale per la funzione dei nervi che controllano i muscoli e il movimento. Senza di essa, le cellule nervose non possono funzionare correttamente, comportando nel tempo debolezza muscolare. A seconda del tipo di Sma, la forza fisica dell’individuo e la sua capacità di camminare, mangiare e respirare può diminuire sensibilmente o venire persa.
Redazione Nurse Times









Lascia un commento