Riceviamo e pubblichiamo un contributo sul tema a cura di Chiara Mattia Chiara, Simona Sciannameo, Sara Macchia, Fiorella De Todaro, Tiziana Pugliese, Raffaele Manzari, Gessica Angelini e Domenico Dentico.
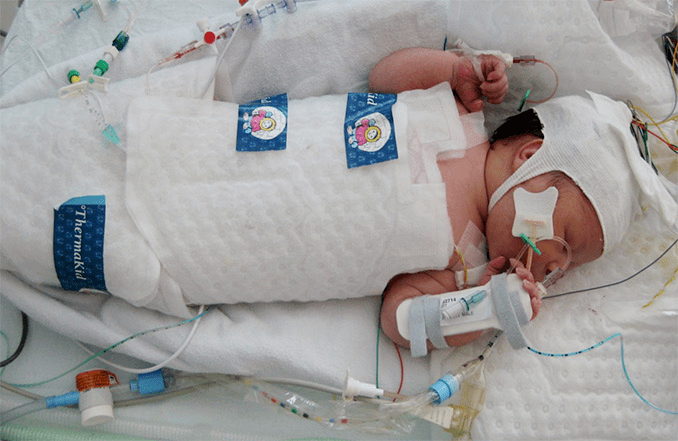
L’ipotermia terapeutica indotta nel neonato, anche chiamata baby cooling, rappresenta il trattamento neuro-protettivo di scelta nell’encefalopatia ipossico-ischemica (EII) di grado moderato o severo, condizione clinica conseguente ad asfissia perinatale che registra una incidenza media di circa 1,6 ogni mille nati vivi e rappresenta una delle cause più frequenti di paralisi infantile cerebrale (6-23%). Il tasso di mortalità dell’EII di grado moderato o elevato varia tra il 10 e il 60%, e tra i sopravvissuti il 25% presenta sequele neurologiche importanti.
Il danno cerebrale che si realizza a seguito di asfissia intrapartum non è un evento unico, ma un processo evolutivoche inizia con l’insulto ipossico-ischemico e nei casi più gravi o prolungati, continua in una seconda fase detta di riperfusione, in cui paradossalmente si ha una maggior distruzione di neuroni. Tra l’evento iniziale e la necrosi neuronale intercorre un intervallo di tempo sufficientemente ampio, detta Therapeutic window, in cui poter attuare strategie neuroprotettive in modo da limitare le conseguenze neurologiche e il rischio di morte del neonato.
Il baby cooling è un trattamento che viene riservato ai neonati a termine o vicino al termine (con età gestazionale superiore o pari a 35 settimane), con un peso corporeo superiore a 1.800 gr e meno di 6 ore di vita. Può essere selettiva se limitata alla testa, ipotermia cerebrale, o sistemica quando interessa l’intero corpo. Tuttavia entrambe le modalità di trattamento determinano un miglioramento in termini di sopravvivenza e outcome neurologico se vengono rispettati i criteri di inclusione raccomandati per l’esecuzione della procedura. I criteri sono rappresentati dai punti A e B.
A – Ipossia perinatale (basta un solo criterio):
- Punteggio Apgar <5 a 10 minuti di vita.
- Necessità di eseguire rianimazione ancora a 10 minuti di vita.
- Acidosi fetale o neonatale con pH <7 e/o ABE >12 mmol/L da Emogasanalisi arteriosa ombelicale o da qualsiasi EGA nei primi 60 min di vita. Si preferisce il sangue ottenuto dall’arteria ombelicale in quanto riflette lo stato fetale a differenza del sangue da vena ombelicale che rappresenta più la situazione placentare.
B – Valutazione neurologica del grado di EII moderata o severa valutata a 30 e 60 minuti di vita in base all’esame obiettivo neurologico (SARNAT II/III).
Dopo aver accertato la presenza di entrambi i criteri di inclusione, si esegue la valutazione aEEG mediante CFM (Cerebral Function Monitoring) o EEG per almeno 30 minuti, possibilmente prima dell’avvio di terapia antiepilettica o sedativa. Una volta confermata la diagnosi, entro le 6 ore di vita, si procede al trattamento ipotermico per 72 ore. Sono esclusi, di conseguenza, i neonati con più di 6 ore di vita e con anomalie congenite gravi e l’eventuale applicazione della procedura dovrebbe essere eseguita solo in contesti di ricerca e con il consenso informato da parte dei genitori. Il trattamento ipotermico rientra nelle procedure con una alta complessità assistenziale e che richiede pertanto personale medico-infermieristico altamente specializzato e formato.
Sono previsti tre livelli di intervento in tre aree d’azione a diversa intensità di cura, in cui i vari professionisti devono essere perfettamente coordinati e condividere necessariamente le procedure di riferimento in modo da realizzare una precoce identificazione dei candidati al trattamento, un tempestivo trasporto e una assistenza appropriata. Se il parto avviene in un punto nascita allora sarà necessario che questo centro periferico (SPOKE) contatti il centro di riferimento (HUB) più vicino non appena valuti il neonato, nel rispetto dei criteri già esposti, candidato all’ipotermia e attivi il Servizio di Trasporto Neonatale (STEN).
Livelli di intervento
I° Livello
Riguarda le azioni eseguite nel Centro Trasferente, che avvierà l’ipotermia ‘passiva’ spegnendo il riscaldamento nell’incubatrice e mantenendo la temperatura del neonato a circa 35°C in attesa dell’arrivo dello STEN.
II° Livello
In questa fase si considera il passaggio di azioni assistenziali e procedurali tra il Centro Trasferente e lo STEN. Il medico del team di trasporto, una volta giunto nel Centro Trasferente, valuterà le condizioni del neonato e deciderà se trasportarlo in respiro spontaneo o in ventilazione assistita anche perché, in caso di asfissia neonatale, il respiro autonomo può essere conservato nel 30% dei casi. Verrà eventualmente reperito un accesso venoso stabile. Lo STEN garantirà il trasporto in apposita incubatrice mantenendo sempre costante la temperatura rettale del bambino a 35°C.
Il raffreddamento può essere ottenuto:
- Spegnendo il riscaldamento della termoculla (ipotermia passiva) e questa misura, in genere, è sufficiente ad abbassare la temperatura del neonato a 35°C considerando anche la riduzione spontanea che si verifica negli asfittici.
- Utilizzando per brevi periodi, se con la misura precedente non si è riusciti ad ottenere l’abbassamento della temperatura, sacchetti di ghiaccio istantaneo o gel raffreddati o guanti monouso riempiti con acqua fredda posizionati attorno al neonato prestando attenzione ad evitare il contatto diretto con la cute e osservando frequentemente la sede interessata.
- Utilizzando sistemi servo-controllati per il raffreddamento durante il trasporto. E’ necessario monitorare o controllare almeno ogni 15 minuti la temperatura rettale (per evitare un eccessivo raffreddamento), la frequenza cardiaca e la saturazione di ossigeno.
III° Livello
Le attività eseguite nel Centro Accettante sono rappresentate dalle seguenti fasi:
1. Esecuzione del tracciato EEG.
2. Induzione.
3. Mantenimento.
4. Riscaldamento o rewarming.
5. Normotermia terapeutica.
Nella prima fase, durante il posizionamento e l’esecuzione del tracciato grafico cerebrale sono necessari alcuni accorgimenti:
- Minimizzare gli stimoli esterni (luce, rumori, manipolazioni), aspetto da considerare anche nelle altre fasi assistenziali.
- Posizionare gli elettrodi per il CFM o EEG.
- Valutare, da parte del medico, i pattern patologici.
Il CFM è un elettromedicale digitale che permette l’elaborazione continua dell’attività elettrica cerebrale del neonato in modo da valutarne eventuali anomalie, soprattutto nei casi di encefalopatia ipossica-ischemica e durante il trattamento ipotermico. Si distinguono diversi tipi di apparecchiature per la registrazione dell’aEEG, tuttavia le più usate nelle TIN sono di solito ad una derivazione interemisferica (P3-P4) e/o a due derivazioni emisferiche centroparietali (C3-P3, C4-P4). Lo sviluppo delle tecniche digitali e la contemporanea registrazione della traccia EEG da cui è derivata la traccia aEEG (la cosiddetta “raw trace”, cioé “traccia grezza”) ha migliorato la capacità di distinguere tra attività elettrica cerebrale vera e artefatti, consentendo una rivalutazione sincronizzata sia della traccia aEEG che della traccia EEG per una più attendibile definizione della natura dei reperti aEEG. Infine, in molte delle macchine di monitoraggio CFM sono incorporati algoritmi automatici di individuazione di crisi (SDA, Seizure Detection Algorythm). Bisogna però ricordare che l’operatore deve sempre verificare la corretta corrispondenza tra segnalazione e crisi reali.
L’amplitude integrated EEG (aEEG) può rilevare solo alterazioni maggiori dell’attività cerebrale senza però poter studiare le singole zone afferenti ed è sensibile ai cambiamenti di ampiezza ma non a quelli di frequenza. Tuttavia è possibile evidenziare pattern patologici che indicano la necessità di attuare il trattamento ipotermico:
- Attività moderatamente anormale (margine superiore >10 mcV e margine inferiore <5 mcV)
- Attività severamente anormale (margine superiore <10 mcV e margine inferiore <5mcV, questo tracciato può essere accompagnato da burst di punte ad alto voltaggio che appaiono come singoli spikes sopra l’attività di base)
- Convulsioni (10-40 mcV e tracciato a dente di sega).
Posizionamento degli elettrodi per ottenere CFM a due derivazioni (C3 – P3, C4 – P4)
- Preparazione materiale necessario (elettrodi, pennarello per cute, ‘centimetro’ di posizionamento, dispositivi di fissaggio, fascia per mantenimento degli elettrodi in sede).
- Pulizia e detersione del cuoio capelluto.
- Posizionamento dell’elettrodo di terra (può essere posizionato anche sulla fronte del paziente).
- Identificare il trago dell’orecchio e con il ‘centimetro’ di posizionamento giungere sino alla fontanella anteriore.
- Far scorrere il ‘centimetro’ sin quando la lettera a livello del trago corrisponda con quella della fontanella.
- Segnare con il pennarello la posizione individuata ad entrambi i lati del ‘centimetro’
- Eseguire la stessa procedura per l’altro orecchio.
- Se i capelli del bambino sono molto lunghi, valutare se radere le zone interessate.
- Delicatamente, inserire gli elettrodi nel sottocute e fissarli accuratamente (steristrip o altri dispositivi secondo protocolli dell’Unità Operativa).
- Collegare gli elettrodi all’apparecchiatura CFM.
- Valutare il corretto posizionamento.
- Avvolgere la testa del paziente con una fascia di contenimento.
E’ in questa fase che l’ipotermia esprime il massimo del suo effetto terapeutico e richiede le seguenti azioni:
- Posizionare un catetere vescicale Foley.
- Assistere il medico nell’impianto di un catetere ombelicale o altra via venosa centrale, procedura necessaria per consentire la somministrazione di soluzioni per alimentazione parenterale. Può essere utile posizionare anche un catetere arterioso ombelicale per monitorare la pressione arteriosa cruenta ed eseguire prelievi.
- Controllare la corretta funzionalità dell’apparecchio per il trattamento ipotermico prima di utilizzarlo sul neonato.
- Considerare la seguente procedura in caso di utilizzo di ‘Arctic Sun’ come dispositivo:
– Accendere ed eseguire test iniziale.
– Selezionare “Nuovo paziente”.
– Controllare il livello dell’acqua e se necessario riempire il serbatoio con acqua distillata sterile selezionando il tasto “Riempire serbatoio”.
– Impostare la funzione “Raffreddare paziente” a 33° per ipotermia sistemica moderata, la durata del trattamento (72 h) e rispettivi livelli Min. e Max di allarme della temperatura del neonato e della temperatura dell’acqua.
– Impostare e programmare la funzione ‘Riscaldare paziente’ dopo le 72 h di trattamento.
– Controllare il flusso dell’acqua che deve essere di almeno 1,5 L/m.
– Lubrificare e introdurre la sonda della temperatura nel retto per circa 6 cm dall’orifizio anale, fissandola poi con un cerotto sulla coscia.
– Verificare periodicamente che la sonda non si dislochi e che non si sporchi di feci, situazioni che interferirebbero sul rilevamento della temperatura e se è necessario rimuoverla, pulirla rapidamente e riposizionarla.
– Utilizzare l’interfaccia di raffreddamento (PAD) avvolgendola sul corpo del neonato.
– Controllare che la temperatura sia mantenuta stabile con minime fluttuazioni tollerabili (0,2-0,3°C). - Valutare costantemente la cute nelle zone interessate dal PAD per scongiurare l’insorgenza di lesioni da freddo come l’adiponecrosi o lesioni da pressione.
- Controllare la postura, mobilizzare frequentemente il paziente per prevenire il rischio di insorgenza di lesioni da decubito ed eventualmente fare uso di creme protettive.
- Evitare di rimuovere la pellicola presente sulla faccia interna del PAD per non porre direttamente a contatto la superficie adesiva sulla cute delicata del neonato.
- E’ necessario una gestione attenta dei liquidi in quanto, il neonato asfittico è a rischio di insufficienza renale e di sindrome da inappropriata secrezione di adiuretina.
- Posticipare, da parte del medico, la supplementazione di potassio durante il raffreddamento, per evitare una pericolosa iperpotassiemia durante il riscaldamento. L’aggiunta di elettroliti è raccomandata dopo 24-48 h quando la funzione renale è migliorata ed è divenuta stabile.
- Rilevare peso, diuresi oraria (oliguria se diuresi <1 ml/Kg/h) e bilancio idrico ogni 8-12h (il rene può aver subito un danno anatomo-funzionale).
- Valutare i parametri vitali (FC, FR, SAT. O2). Considerare che è prevista una riduzione della frequenza cardiaca nel neonato asfittico e che l’ipotermia la riduce ulteriormente di 14 b/m per ogni °C di abbassamento della temperatura. Se la FC si abbassa pericolosamente a meno di 80 b/m si consiglia di innalzare di 0,5-1° la temperatura impostata.
- Controllare i livelli glicemici che siano >46 mg/dl.
- Gestire l’assistenza ventilatoria. L’ipotermia da sola non rappresenta, comunque, una indicazione al ricorso alla ventilazione meccanica a meno che non siano presenti altre situazioni come l’insufficienza respiratoria, ripetute apnee o desaturazioni associate a convulsioni. Evitare ipocapnia che potrebbe avere effetti deleteri sul circolo cerebrale e causare vasocostrizione. Mantenere saturazioni di ossigeno > 92% per diminuire il rischio di ipertensione polmonare.
- Eseguire la terapia prescritta per sedo-analgesia, trattamento delle eventuali convulsioni, doppio antibiotico per sepsi e trattamento farmacologico dell’eventuale ipotensione.
- Eseguire ECG ogni giorno per valutare il ritmo cardiaco (il QT può essere allungato e indicare presenza di ischemia cardiaca).
- Monitorare la pressione arteriosa (PA) cruenta o incruenta ogni 2 ore o secondo necessità cliniche (PA media > 40 mmHg).
- Effettuare prelievo per esami di laboratorio secondo prescrizione medica (PCR, emocromo, emocoltura, coagulazione, creatininemia, azotemia, elettroliti e troponine).
- Valutare da parte del medico la possibilità di una alimentazione enterale non nutritiva (MEF) durante il trattamento e al termine di iniziare, con cautela, l’alimentazione per bocca o gavage.
- Collaborare con il medico e con altri operatori per l’esecuzione di esami strumentali (ecografia transfontanellare, ecocardiogramma, radiografie). Si può dire che l’ipotermia sia un trattamento sia sicuro, che con una bassa incidenza di eventi avversi, comunque non gravi. Gli effetti collaterali più frequenti sono rappresentati da bradicardia sinusale, trombocitopenia e adiponecrosi associata o meno a ipercalcemia anche tardiva.
Fase del riscaldamento (rewarming) e del raggiungimento della normotermia. In questa fase è indispensabile:
1. Controllare, dopo 72 ore di trattamento, che inizi la fase di riscaldamento del neonato e che la sua temperatura corporea passi da 33° lentamente a 36,5°C con incrementi di 0,5°C/ora e questo per evitare un rapido incremento con il rischio di innescare crisi convulsive e di annullare quindi gli effetti benefici indotti dal trattamento ipotermico.
2. Svuotare il PAD, al termine della terapia, prima di staccarlo dal tubo valvolato, per evitare che fuoriesca acqua, utilizzando l’apposito tasto presente sulla schermata principale del display.
3. Smaltire il PAD e la sonda nell’apposito contenitore di rifiuti in quanto presidi monouso.
Follow-up
E’ importante che il medico programmi il follow-up per RM-encefalo a 7-10 giorni o comunque almeno entro il primo mese di vita e il controllo psicomotorio e neurosensoriale a 2-3 anni da proseguire fino all’età scolare.
Conclusioni
L’infermiere, nel contesto multiprofessionale, multidisciplinare e multidimensionale in cui si trova ad agire, può gestire la complessità assistenziale legata a questa procedura solo se è preparato, formato e abbia ben presente l’importanza del rispetto delle procedure e dei protocolli specifici. Alcuni studi evidenziano anche l’importanza di avere nel team infermieri competenti nella prevenzione e nel trattamento delle lesione da pressione e che sappiano gestire il rischio di insorgenza di lesioni con opportune scale di valutazione (Braden-Q, NSRAS e Glamorgan). Bisogna, inoltre, considerare la responsabilità medica-infermieristica nel fornire una corretta e opportuna informazione ai genitori riguardo le manovre assistenziali utilizzate e gli aggiornamenti sulla situazione clinica del loro bambino. E’ fondamentale il coinvolgimento dei genitori in semplici attività soprattutto nella fase successiva al trattamento ipotermico, in modo da favorire un maggiore contatto e garantire il benessere nel rapporto madre/padre-figlio.
Bibliografia
- Gruppo di Studio di Neurologia Neonatale (SIN) ‘Raccomandazioni per l’assistenza al neonato con encefalopatia ipossico-ischemica candidato al trattamento ipotermico’ II Edizione 2012 – Ed. Biomedia.
- Inder TE, Hunt RW, Morley CJ, et al. Randomized trial of systemic hypothermia selectively protects the cortex on MRI in term hypoxic-ischemic encephalopathy. J Pediatr. 2004;145(6):835–837.
- Linee guida dell’International Liaison Committee on Resuscitation (ILCOR). 2010.
- Manzari Raffaele, Dentico Domenico ‘L’ipotermia terapeutica indotta nel neonato.’ OPI Bari Filodiretto no. 3-4-5 2021, pp. 11-14.
- Pasek TA, Geyser A, Sidoni M, Harris P, Warner JA, Spence A, Trent A, Lazzaro L, Balach J, Bakota A, Weicheck S ‘Skin care team in the pediatric intensive care unit: a model for excellence’ Crit Care Nurse. 2008 Apr;28(2):125-35.
- Rutherford M, Ramenghi LA, Edwards AD, et al. Assessment of brain tissue injury after moderate hypothermia in neonates with hypoxic-ischaemic encephalopathy: a nested substudy of a randomised controlled trial. Lancet Neurol. 2010;9(1): 39-45.
Autori
Mattia Chiara, Sciannameo Simona, Macchia Sara, De Todaro Fiorella, Pugliese Tiziana, Manzari Raffaele, Angelini Gessica e Dentico Domenico.
Redazione Nurse Times
- Secondo infarto: nuovo marcatore indica pazienti a maggiore rischio
- Liberi dal blister: quando l’organizzazione della terapia libera chi cura
- Corso Ecm (16 crediti) Fad gratuito per infermieri: “La sostenibilità ambientale dei sistemi sanitari – Seconda edizione”
- Asp Distretto Fidenza (Parma): concorso per 8 posti da infermiere
- Ssr Marche, concorso in forma aggregata per 32 posti da infermiere









Lascia un commento