Si tratta di teplizumab (nome commerciale: Tzield), sviluppato e commercializzato da Provention Bio.
La statunitense Food and Drug Administration (Fda) ha approvato il farmaco endovena teplizumab per ritardare l’insorgenza del diabete di tipo 1 (T1D) in stadio 3 negli adulti e nei pazienti pediatrici di età pari o superiore a 8 anni che attualmente hanno il diabete di tipo 1 in stadio 2. Sviluppato e commercializzato da Provention Bio con il nome di Tzield, è il primo farmaco immunoterapico, modificante la malattia, che non agisce sui sintomi del diabete, ma ne ritarda la progressione.
“L’approvazione di tale terapia aggiunge un’importante nuova opzione di trattamento per alcuni pazienti a rischio – ha affermato John Sharretts, direttore della Division of Diabetes, Lipid Disorders, and Obesity del Center for Drug Evaluation and Research della Fda –. Il potenziale del farmaco di ritardare la diagnosi clinica del diabete di tipo 1 può fornire ai pazienti mesi o anni senza il peso della malattia”.
Teplizumab è un anticorpo anti-CD3 (un antigene di superficie cellulare presente sui linfociti T) che funziona riprogrammando il sistema immunitario per impedire che attacchi erroneamente le cellule pancreatiche che producono insulina. Il diabete di tipo 1 (tipico di bambini e nei giovani adulti) è infatti dovuto a una disfunzione del sistema immunitario che attacca e distrugge le cellule pancreatiche che producono l’ormone. Motivo per cui chi ne soffre deve fare ricorso a iniezioni ripetute giornaliere di insulina per controllare la glicemia.
Teplizumab si lega ad alcune cellule del sistema immunitario e ritarda la progressione del diabete di tipo 1 in stadio 3 disattivando le cellule immunitarie autoreattive che attaccano le cellule beta del pancreas. Allo stesso tempo aumenta la proporzione di cellule T regolatorie e cellule T CD8+ esaurite nel sangue periferico, che aiutano a moderare la risposta immunitaria.
Commenta Eleanor Ramos, Chief Medical Officer presso Provention Bio: “La progressione del T1D può essere particolarmente onerosa. I pazienti che passano dallo stadio 2 allo stadio 3 possono sviluppare chetoacidosi diabetica, che può essere pericolosa per la vita e può verificarsi in circa il 50% dei pazienti in stadio 3. L’esordio di questa fase di diabete è un momento che cambia la vita: una volta che le cellule produttrici di insulina non sono più in grado di mantenere il normale controllo glicemico, questa condizione irreversibile può portare alla necessità, in un solo anno, per un paziente, di 1.460 pungidito per controllare i livelli di glucosio nel sangue, circa 1.100 iniezioni di insulina e una media di 127 episodi di ipoglicemia. Complicazioni che possono causare stress, paura e ansia nei pazienti”.
La sicurezza e l’efficacia di teplizumab sono state valutate in uno studio randomizzato, in doppio cieco, basato su eventi, controllato con placebo con 76 pazienti con diabete di tipo 1 in stadio 2. Nello studio i pazienti hanno ricevuto in modo casuale il farmaco o un placebo una volta al giorno tramite infusione endovenosa per 14 giorni. La misura primaria dell’efficacia era il tempo dalla randomizzazione allo sviluppo della diagnosi di diabete di tipo 1 in stadio 3.
I risultati dello studio hanno mostrato che in un follow-up mediano di 51 mesi, al 45% dei 44 pazienti che hanno ricevuto teplizumab è stato successivamente diagnosticato un diabete di tipo 1 in stadio 3, rispetto al 72% dei 32 pazienti che hanno ricevuto un placebo. Il tempo medio dalla randomizzazione alla diagnosi del diabete di tipo 1 in stadio 3 è stato di 50 mesi per i pazienti che hanno ricevuto teplizumab e di 25 mesi per quelli che hanno ricevuto un placebo. Ciò rappresenta un ritardo statisticamente significativo nello sviluppo del diabete di tipo 1 in stadio 3.
Tra gli effetti collaterali più comuni sono stati segnalati una riduzione dei livelli di alcuni tipi di globuli bianchi, eruzioni cutanee e mal di testa. L’uso di teplizumab è accompagnato con avvertenze e precauzioni, inclusa la premedicazione e il monitoraggio dei sintomi della sindrome da rilascio di citochine. Il medicinale ha ricevuto le designazioni Priority Review e Breakthrough Therapy negli Stati Uniti, dove Provention Bio lo lancerà sul mercato in co-promozione con Sanofi.
Redazione Nurse Times
Fonte: AboutPharma
- Stato-Regioni, Fials: “Documento condivisibile solo in parte. Forte preoccupazione sul Ddl professioni sanitarie”
- Atto di indirizzo 2026, la crisi degli infermieri mette a rischio la riforma del Ssn
- Sarcoma miogenico, all’Asst Gaetano Pini – CTO una protesi restituisce il futuro
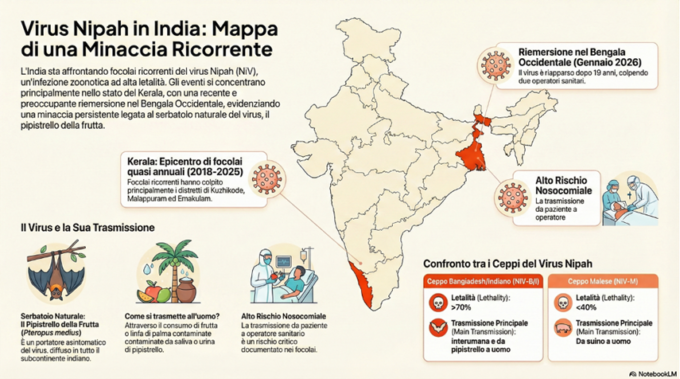
- Virus Nipah: dal focolaio in India ai protocolli di biocontenimento per la Provincia di Cuneo
- Punito perché caregiver: la denuncia dell’insegnante siciliano Francesco Malizia









Lascia un commento