Okay della Food and Drug Administration alla produzione del farmaco da parte di Harm Reduction Therapeutics Inc.
La statunitense Food and Drug Administration (Fda) ha concesso a un’azienda farmaceutica no profit la corsia accelerata per produrre una medicina anti-overdose da utilizzare senza prescrizione medica. Lo riporta il Wall Street Journal.
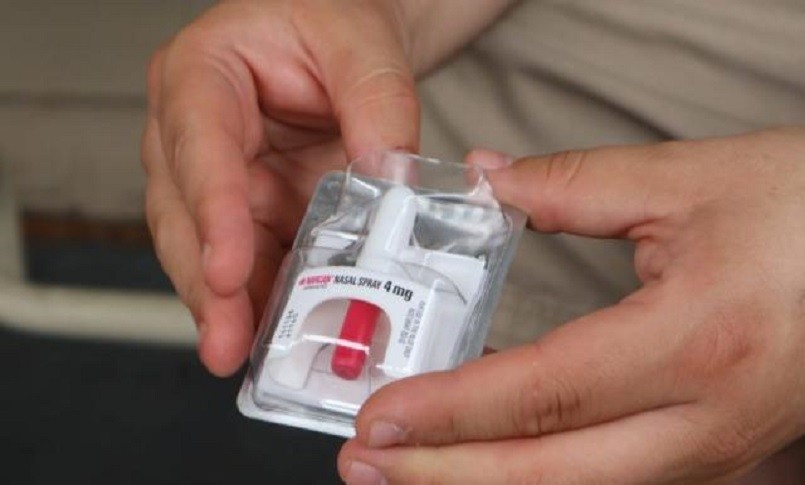
Harm Reduction Therapeutics Inc. sostiene che il suo farmaco, uno spray nasale a base di naloxone che è stato chiamato Rivive, ha una concentrazione tre volte superiore rispetto alla somministrazione dello stesso principio attivo con un’iniezione. Secondo la no profit, l’approvazione ufficiale da parte della Fda dovrebbe arrivare il 28 aprile. Hrt prevede di produrre 2 milioni di dosi l’anno del farmaco, donarne un decimo e vendere il resto a farmacie e organizzazioni che lavorano con i tossicodipendenti per 18 dollari a dose.
Le morti per overdose, soprattutto da oppiodi come il famigerato fentanyl, sono una piaga negli Stati Uniti: nel 2021 sono state 107.622, con un aumento del 15% rispetto al 2020.
Redazione Nurse Times
Rimani aggiornato con Nurse Times, seguici su:
Telegram https://t.me/NurseTimes_Channel
Instagram https://www.instagram.com/nursetimes.it/
Facebook https://www.facebook.com/NurseTimes.NT
- Maternità non penalizza le lavoratrici: storica sentenza in favore di una Oss contro l’ASL di Taranto
- Recupero dopo ictus: decisivo il contributo dell’emisfero cerebrale opposto alla lesione
- Asst Gaetano Pini – CTO di Milano: concorso per un posto da infermiere pediatrico
- La sanità che apre concorsi come il supermercato apre casse
- Asst Gaetano Pini – CTO di Milano: concorso per 10 posti da infermiere











Lascia un commento