L’Emogasanalisi (EGA) rappresenta uno degli esami fondamentali, se non quello “principe” in urgenza, poiché ci garantisce un’ottimale quadro di lettura sulla ventilazione alveolare, gli scambi gassosi, il pH ematico e l’equilibrio acido-base (EAB)
In particolare l’EAB costituisce una “spia” di importanti funzioni come lo stato di idratazione (pazienti disidratati solitamente presentano un’alcalosi metabolica) e la circolazione (molte volte i pazienti in stato di shock presentano acidosi metabolica). L’emogasanalisi è uno strumento fondamentale per valutare queste condizioni cliniche.
L’esame consiste in un prelievo arterioso a livello dell’arteria radiale, brachiale o femorale; può essere anche eco-guidato. Il sangue intero è prelevato tramite una siringa eparinata, all’interno della quale non devono esservi bolle d’aria al fine di evitare un’alterazione dei valori biochimici gassosi del campione prelevato.
Si tratta di un esame estremamente frequente in ambiente ospedaliero che però cela dietro di sé un mistero per molti infermieri: come interpretare in modo corretto i dati fornitici dal “Dio” emogasanalizzatore? Questo articolo cercherà di fornire in maniera concisa e sistematica le basi per una corretta interpretazione di un referto emogas.
Prima però di addentarci nel vivo del discorso occorre fare un ripasso sulla fisiologia.
Le specie chimiche maggiormente coinvolte nell’equilibrio acido-base sono l’acqua e l’anidride carbonica. L’anidride carbonica in presenza di acqua forma l’acido carbonico tramite una reazione catalizzata dall’anidrasi carbonica. Questo enzima rende istantanea una reazione altrimenti molto lenta.
CO2 + H2O ←→ H2CO3
Maggiore sarà la concentrazione di anidride carbonica (CO2) disciolta nell’acqua, maggiore sarà la concentrazione di acido carbonico (H2CO3). Già questo inizia a farci comprendere come la respirazione, che porta alla produzione di anidride carbonica, abbia influenza sulla produzione di composti acidi e basici. La reazione evidenzia una specie chimica acida (H2CO3) la quale ha una sua costante di dissociazione (pKa). La pKa, in sintesi, indica la tendenza di uno specifico acido, in questo caso acido carbonico a dissociarsi in idrogenioni (H+) e nella sua base coniugata, in questo caso ioni bicarbonato (HCO3-). Il suo equilibrio è rappresentato dalla seguente formula:
H2CO3 ←→ H+ + HCO3 –
Un aumento della concentrazione di idrogenioni è responsabile di una diminuzione del pH ematico; viceversa un incremento della concentrazione di ioni bicarbonato è responsabile di un aumento del pH.
Il pH è la misura logaritmica della concentrazione di ioni idrogeno (H+). La misura logaritmica inverte il segno della concentrazione potendo generare una incomprensione.
Può venire infatti spontaneo pensare che se aumenta la concentrazione di idrogenioni il pH aumenta perché esso misura la loro concentrazione: il pH invece diminuisce!
Il problema risiede nel fatto che se misurassimo la concentrazione di una specie chimica come l’H+ senza utilizzare la scala logaritmica ritroveremmo a fare i conti con numeri estremamente complessi e tanti zeri (l’H+ è presente in ragione di qualche decina di nanoequivalenti = 0,0000001 mEq/l). Utilizzando i nanoequivalenti avremmo inoltre difficoltà interpretative poiché ad una variazione del pH non corrisponde sempre una esatta variazione dei nanoequivalenti. La misurazione logaritmica del pH si calcola con la seguente formula:
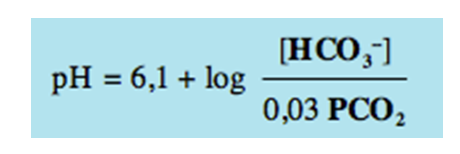
Questa formula si chiama equazione di Henderson- Hasselbach.
Osservando l’equazione si possono riconoscere le due molecole maggiormente coinvolte nell’equilibrio acido base: il bicarbonato (HCO3–) e l’anidride carbonica (CO2) .
Applicando la Henderson Hasselbach si possono comprendere alcuni concetti importanti: ad un aumento dell’anidride carbonica si verifica una riduzione del pH, mentre ad un incremento del bicarbonato si ha un aumento del pH. In altre parole è come se dicessimo che ad incrementi della CO2 (dovuti a difficoltà respiratorie oppure ad una sua maggiore produzione) l’acidità nell’organismo tende ad aumentare, mentre una sua diminuzione tende a farla ridurre. Allo stesso modo un aumento della concentrazione dell’HCO3– tende ad aumentare il pH ed una sua diminuzione tende a ridurlo. Nell’organismo però le cose non sono così semplici. Vediamo ora di comprendere cosa succede in vivo.
CO2 + H2O ←→ H2CO3 ←→ H+ + HCO3–
L’unione delle prime due formule rende più concreta l’idea di quello che succede nella realtà. Il comportamento di queste specie chimiche sopracitate si può spiegare con la legge di massa: i prodotti a destra e a sinistra dell’equazione devono rimanere costanti o meglio in equilibrio, perciò se si verifica un aumento di una specie chimica a sinistra dell’equazione, l’altra (quella di destra), per bilanciare, deve aumentare anch’essa. Per esempio, se aumenta l’HCO3– si ha un corrispondente aumento della CO2.
Di fatto un aumento dell’HCO3– provoca un aumento della produzione di acido carbonico (H2CO3). Un aumento dell’acido carbonico è responsabile di un incremento della produzione di CO2, spostando l’equilibrio verso sinistra. Se il paziente è in grado di ventilarsi efficacemente eliminerà con la respirazione l’eccesso di CO2, se invece la capacità ventilatoria è ostacolata (o la gittata cardiaca è ridotta) avremo un incremento della CO2, con conseguente riduzione del pH ematico e acidosi respiratoria paradossa.
Allo stesso modo un aumento della CO2 sposta l’equilibrio verso destra, incrementando la produzione di acido carbonico che deve essere compensata da una maggiore produzione di bicarbonato in quanto consumato dall’acido prodotto.
Per cui, a variazioni del pH ematico corrispondono compensazioni rapide che sfruttano l’apparato respiratorio e croniche che utilizzano la capacità dei reni di riassorbire bicarbonato. Oltre alla CO2 esiste un’altra sorgente di acidi, essi sono prodotti durante il metabolismo degli amminoacidi e sono più comunemente conosciuti come “acidi fissi”. Gli acidi fissi non possono essere eliminati con la respirazione. Questi acidi sono tamponati dal bicarbonato prodotto a livello del tubulo prossimale renale oppure sono eliminati come NH4+ (ione ammonio) a livello dei tubuli collettori renali.
Esistono altri tamponi che sfruttando altre basi (oltre al bicarbonato) compensano le variazioni del pH, essi si trovano sia nello spazio extracellulare sia in quello intracellulare. La base intracellulare contenuta in maggior quantità è l’emoglobina, essa è presente nei globuli rossi e costituisce circa l’80% della capacità del sistema tampone extra-bicarbonato, il rimanente è costituito da altre proteine come l’albumina, l’ATP (adenosina trifosfato), il 2-3 difosfo-glicerato ed i fosfati organici ed inorganici. Il bicarbonato possiede circa il 40% della capacità tampone totale, l’emoglobina il 35%, altre proteine (la più importante è l’albumina) 7%, il fosfato organico 3% ed il fosfato inorganico 2%. Con l’emogasanalisi purtroppo non è possibile determinare con esattezza la loro concentrazione.
INTERPRETAZIONE

Tra diversi metodi del ‘interpretazione dell’EGA ho deciso di illustrarvi quello proposto dall’IRC (Italian Resuscitation Council) nel loro corso di ALS (Advanced Life Support), esso è di fatti semplice e di rapida esecuzione. Si articola in cinque passi da analizzare, personalmente prima dei cinque passi previsti da questo metodo ne aggiungerei un sesto ovvero quello del valutare il paziente:
- Valutare il paziente;
- Valutare l’ossigenazione (pO2);
- Valutare il pH;
- Valutare l’anidride carbonica (pCO2);
- Valutare il Bicarbonato (HCO3–);
- Valutare il compenso atteso (disturbi semplici e misti).
- Valutare il paziente
Le condizioni cliniche del paziente ed il dato anamnestico sono i primi elementi da considerare prima di cimentarsi nell’interpretazione.
La presenza di acidosi respiratoria cronica (BPCO) e/o la presenza di condizioni che si associano ad alcalosi respiratoria cronica (es. gravidanza) sono elementi necessari al fine di calcolare il compenso corretto. Inoltre, conoscere la storia clinica del paziente, aiuta nella corretta interpretazione dei dati. Ad esempio un paziente che abbia superato una fase di arresto continuo avrà un’elevata probabilità di avere un’acidosi metabolica lattica mentre un paziente ventilato eccessivamente potrà presentare una alcalosi respiratoria iatrogena.
Ricordate sempre di guardare il paziente, non i dati!!!! Un referto EGA, come i valori di un monitor non significano nulla se non correlati alla situazione globale del nostro paziente!
- Valutare l’ossigenazione
La prima domanda da porci è se ci troviamo davanti ad un paziente ipossico.
Per comprenderlo occorrerebbe calcolare l’apporto di ossigeno nell’intero organismo (DO2) calcolabile con la seguente formula: DO2 = CO × CaO2. dove CO è la gittata cardiaca e CaO2 è il contenuto arterioso di ossigeno che è la somma dell’ossigeno legato all’emoglobina [prodotto della concentrazione di emoglobina (Hb) e della saturazione arteriosa di O2 (SaO2)] e dell’ossigeno fisicamente disciolto (pO2): CaO2 = (Hb × 1.36 × SaO2) + (pO2 × 0.0031).
Si tratterebbe però di un calcolo molto complicato e non di certo rapido dal punto di vista del reperimento dei dati.
Per semplicità nella valutazione dell’ossigenazione si fa riferimento al valore di pO2 ovvero la pressione parziale arteriosa di ossigeno disciolto nel sangue. I valori normali della pO2 variano da 80 a 100 mmHg. Un aumento porta ad una iperossia mentre una diminuzione ad un’ipossia. Occorre tenere conto che la pO2 diminuisce fisiologicamente con l’aumentare dell’età.
Il valore di pO2 riscontrato deve essere sempre confrontato con la percentuale di ossigeno che il paziente sta respirando, ovvero il rapporto P/F che semplicemente consiste nel rapporto tra pO2 e FiO2 (Frazione inspiratoria di ossigeno ovvero la percentuale di ossigeno respirato in aria, per l’aria ambiente è del 21%), esso è indice della respirazione alveolare. Il rapporto P/F in un paziente sano è indicativamente di 450; generalmente, un P/F superiore a 350 è da considerarsi fisiologico; un P/F inferiore a 200 è indice di grave insufficienza respiratoria.
Altro valore da tenere in considerazione è il gradiente alveolo-arterioso di ossigeno PA-aO2 che corrisponde alla differenza tra la pressione alveolare di ossigeno (PAO2) e la pressione parziale arteriosa di ossigeno (pO2), valori normali sono tra 5 e 25 mmHg; valori patologici di insufficienza respiratoria sono considerati con una PA-aO2 inferiore a 5 mmHg. Solo a titolo informativo, la formula per il calcolo della PA-aO2 è la seguente:
PAO2 = FiO2 x (Pb – PH2O) – pCO2 / R
PB = Pressione Barometrica (mmHg)
PH2O = Vapore di Acqua (pressione parziale) (mmHg)
R = Quoziente Respiratorio (v.n. 0.7 – 1)
3. Valutare il pH
Il valore di pH normale è compreso tra 7,35 e 7,45 e riflette la concentrazione di acidi [H+] nel sangue. Mantenere il pH entro questi valori è fondamentale per un corretto funzionamento del organismo. Gli enzimi, infatti, sono proteine e la conformazione di queste ultime, dalla quale dipende il corretto funzionamento, è correlato strettamente al valore di pH. Il pH è detto acido se è inferiore a 7,35 mentre è detto alcalino se è maggiore di 7,45.
Come già illustrato sopra in maniera più approfondita, il pH dipende dalla concentrazione di pO2 e di HCO3– come si può desumere dall’equazione di Henderson-Hasselbalch.
Più elevato sarà il valore di HCO3– (numeratore) più alto sarà il valore del pH (alcalosi), mentre più alto il valore di pCO2 (denominatore) più basso sarà il valore di pH (acidosi). Per gli stessi motivi matematici, bassi valori di HCO3– causeranno acidosi, mentre bassi valori di pCO2 determineranno alcalosi.
Dal pH capiamo se il paziente è in equilibrio oppure no. Quanto più si discosta tale valore dalla normalità, tanto più il paziente sarà in condizioni critiche.
- Valutare l’anidride carbonica
L’anidride carbonica rappresenta il prodotto finale del catabolismo tissutale. Dai tessuti l’anidride carbonica viene trasportata, all’interno dei globuli rossi, ai polmoni e qui viene eliminata attraverso la respirazione. La rimozione della CO2 prodotta dipende pertanto dalla capacità del sangue di arrivare dai tessuti al polmone (portata cardiaca) e dalla capacità del polmone di eliminare l’anidride carbonica (diffusione e ventilazione).
Se si verifica un accumulo di pCO2, ad esempio per una diminuzione della ventilazione polmonare, avremo un’acidosi, mentre nel caso contrario si verificherà un’alcalosi. Dal momento che il responsabile di tale alterazione è il polmone, si parlerà di acidosi o alcalosi respiratoria.
Cerchiamo di capire meglio perchè un accumulo di pCO2 determina acidosi mentre una eccessiva eliminazione determina alcalosi.
Per fare ciò dobbiamo conoscere l’equazione che regola il sistema tampone dei bicarbonati:
H2O+ CO2 = [H+] + [HCO3–]
Se aumenta la concentrazione di CO2, ad esempio perchè il paziente ipoventila, avremo uno spostamento dell’equilibrio della formula verso destra, con una maggiore produzione di H+ e HCO3– in maniera uguale (equimolare). Ma se i due prodotti seguono la stessa proporzione come fa a svilupparsi acidosi? Ciò è dovuto dal fatto che la concentrazione iniziale di ioni HCO3– è 1000000 di volte superiore a quella degli ioni H+.
Quindi ogni incremento avverrà in questa proporzione (esempio semplificativo):
[H+] [HCO3–]
+1 CO2 1 1000001
+2 CO2 2 1000002
+3 CO2 3 1000003
+4 CO2 4 1000004
+5 CO2 5 1000005
Se la CO2 aumenta di 5 volte la concentrazione di H+ aumenta in maniera sproporzionata rispetto all’HCO3–, rispetto al suo valore basale, determinando acidosi. Una diminuzione della CO2 provocherà, invece, alcalosi per meccanismo contrario.
Di fronte ad alterazioni del pH la prima cosa che dobbiamo fare è capire se tale disordine è dovuto ad un’alterazione dei valori di pCO2, in altre parole dobbiamo capire se il disordine primario è respiratorio o meno.
- Se il pH è < 7,35 (acidosi) ed i valori di pCO2 sono elevati (> 45 mmHg) ci troviamo di fronte ad acidosi respiratoria, cioè il disordine primario che ha causato la diminuzione del pH è l’aumento della CO2.
- Se il pH è > 7,45 (alcalosi) ed i valori di pCO2 sono bassi (< 35 mmHg) ci troviamo di fronte ad alcalosi respiratoria, cioè il disordine primario che ha causato l'aumento del pH è la diminuzione della CO2.
- Se una delle due suddette condizioni fosse veritiera e quindi aveste riconosciuto una acidosi o alcalosi respiratoria, saltate il punto successivo (5) e passate direttamente al punto numero 6.
Nel caso in cui fossero, invece, disattese le suddette ipotesi (es pH < 7,35 e pCO2 bassa o pH > 7,45 con pCO2 elevata) passare al prossimo punto (5).
- Valutare il bicarbonato
Il bicarbonato rappresenta il maggior sistema tampone dell’organismo. Il compito di un tampone è quello di ridurre al minimo le variazioni di [H+]. Una delle maggiori fonti di [H+] deriva dal catabolismo degli alimenti.
I tamponi rappresentano un mezzo molto efficace, ma temporaneo, per rimuovere gli [H+] dall’organismo. Perché un sistema tampone sia efficiente è necessario che sia presente in grande quantità e che sia rigenerabile ed il bicarbonato presenta entrambe queste caratteristiche.
- Se l’eccesso di [H+] non viene eliminato attraverso i sistemi tampone, si lega con le proteine dell’organismo alterandone la morfologia e quindi la funzione (processo che in tempi più o meno brevi porta a morte cellulare).
- Se il pH è < 7,35 (acidosi) ed i valori di HCO3– sono bassi (< 22 mEq/l) ci troviamo di fronte ad acidosi metabolica, cioè il disordine primario che ha causato la diminuzione del pH è una perdita di bicarbonato (es. diarrea) o un aumento di acidi che consumano il sistema tampone bicarbonato (es. chetoacidosi diabetica) facendo diminuire la concentrazione di HCO3– sierico.
- Se il pH è > 7,45 (alcalosi) ed i valori di HCO3– sono elevati (> 26 mEq/l) ci troviamo di fronte ad alcalosi metabolica, cioè il disordine primario che ha causato l’aumento del pH è un aumento di bicarbonato (es. iatrogeno) oppure una perdita di acidi (es. vomito).
- Valutare il compenso atteso
A questo punto si dovrebbe essere in grado di sapere se ci si trova di fronte ad una acidosi o alcalosi respiratoria o metabolica, ovvero conoscere il disturbo primario.
Stabilito il disturbo primario è necessario calcolare il compenso atteso. Ad ogni alterazione dell’equilibrio acido-base, l’organismo lavora in modo tale da mantenere ugualmente la neutralità attraverso meccanismi di compenso.
Se il compenso atteso è rispettato ci troveremo di fronte ad un disturbo semplice, in caso contrario ci troveremo di fronte ad un disturbo complesso.
In caso di acidosi respiratoria, disturbo caratterizzato da un aumento della pCO2, l’organismo reagisce rigenerando una maggiore quota di bicarbonato a livello renale. Questo meccanismo inizia appena il pH scende sotto i valori ottimali ma impiega alcuni giorni per attivarsi al massimo. L’incremento atteso dell’HCO3– è di 1 mEq/l per ogni incremento di 10 mmHg di pCO2 in fase acuta e di 3,5 mEq/l per ogni incremento di 10 mmHg di pCO2 in fase cronica (cioè se l’acidosi respiratoria perdura oltre i 2-3 giorni).
L’acidosi respiratoria si manifesta quando si verifica un accumulo di pCO2 e ciò si verifica per patologie che possono verificarsi in qualsiasi anello della catena ventilatoria:
- Sistema Nervoso Centrale (farmaci, stroke cerebri, trauma cranico, infezioni cerebrali)
- Vie Aeree (ostruzione, asma, BPCO)
- Parenchima polmonare (enfisema, ARDS, polmonite multilobare, edema polmonare acuto)
- Neuromuscolare (distrofia)
- Pleura/parete (PNX, versamento pleurico massivo)
In caso di alcalosi respiratoria, disturbo caratterizzato da una diminuzione della pCO2, l’organismo reagisce eliminando una quota di bicarbonato a livello renale. Questo meccanismo inizia appena il pH sale al di sopra dei valori ottimali ma, come per l’acidosi respiratoria, impiega alcuni giorni per attivarsi al massimo. La diminuzione attesa dell’HCO3– è di 2 mEq/l per ogni decremento di 10 mmHg di pCO2 in fase acuta e di 5 mEq/l per ogni decremento di 10 mmHg di pCO2 in fase cronica.
L’alcalosi respiratoria si manifesta quando si verifica una diminuzione della pCO2 e ciò si verifica in caso di iperventilazione:
- Stimolazione del sistema nervoso centrale (ansia, psicosi, febbre, stroke, infezioni, neoplasia, trauma, dolore)
- Ipossia (elevate altitudini, polmonite, edema polmonare, anemia severa)
- Farmaci e ormoni (gravidanza/progesterone, salicilati)
- Stimolazione dei recettori toracici (versamento pleurico, insufficienza cardiaca, embolia polmonare)
- Altre cause (sepsi, insufficienza epatica, iperventilazione meccanica, esposizione al caldo, recupero di acidosi metabolica).
In caso di acidosi metabolica, disturbo caratterizzato da un aumento della concentrazione di [H+] o da una perdita di HCO3–, l’organismo reagisce eliminando acidi volatili, cioè pCO2, mediante un aumento della ventilazione. Questo meccanismo si attiva rapidamente e si protrae nel tempo sino a quando si instaura stanchezza dei muscoli respiratori (non è prevista una fase cronica del compenso, come accade a livello renale). La diminuzione attesa della pCO2 è di 1,2 mmHg per ogni decremento di 1 mEq/l di HCO3–.
Per capire se l’acidosi è provocata da un aumento della quota acida o da una perdita di bicarbonati dobbiamo introdurre il concetto di gap anionico (AG).
Gap anionico letteralmente significa disavanzo anionico, cioè disavanzo di ioni a carica negativa. Nel nostro organismo le cariche positive (cationi) devono essere uguali a quelle negative (anioni) per mantenere l’elettroneutralità. Le principali cariche positive sono date dal sodio (Na+) e dal potassio (K+) mentre le principali cariche negative sono date dal cloro (Cl–) e dal bicarbonato (HCO3–).
Se nel soggetto sano proviamo a sottrarre gli anioni ai cationi ci accorgiamo che il risultato non è zero, come ci si potrebbe aspettare.
AG = Cationi – Anioni = (Na+ + K+) – (Cl + HCO3) = (140 + 4) – (104+25) = 15 (vn < 12-16)
Il valore di AG rappresenta la quota di anioni che normalmente non vengono misurati negli esami sierici (proteine, solfati, fosfati). Se tali valori fossero misurati la differenza tra cationi e anioni sarebbe zero.
Se l’acidosi è provocata da un aumento della quota acida, l’acido aggiunto si dissocia in [H+] e nel suo anione corrispondente [A–]. Lo ione idrogeno reagisce con il tampone bicarbonato [HCO3] riducendone così la quantità e l’anione [A–] ne prende il posto garantendo così l’elettroneutralità. Un esempio pratico è dato dall’acidosi lattica.
Ipossia –> Acido Lattico = [H+] + [Lattato–] –> HCO3– + [H+] + [Lattato–] = H2O + CO2 + [Lattato-]
Assumiamo di aggiungere una quota di lattato in grado di ridurre HCO3- dal valore normale di 25 mEq/l a 15 mEq/l. La riduzione di HCO3 si farà sentire nell’equazione del calcolo dell’AG:
AG = Cationi – Anioni = (Na+ + K+) – (Cl– + HCO3) = (140 + 4) – (104+15) = 25 (vn < 12-16)
L’acidosi metabolica a GAP aumentato è dovuta ad un aumento della quota acida:
- Chetoacidosi (diabetica, alcolica, digiuno)
- Acidosi lattica
- Insufficienza renale (aumenta la quota di acidi non titolabili)
- Intossicazioni (metanolo, glicole etilenico, salicilati, paraldeide)
Se l’acidosi metabolica è provocata da una perdita di bicarbonato, invece, il rene reagirà aumentando il riassorbimento di cloro (Cl-) poichè l’elettroneutralità deve essere sempre rispettata. Assumiamo di perdere una quota di bicarbonato di 10 mEq/l. Il rene reagirà riassorbendo circa 10 mg/dl di cloro per garantire l’elettroneutralità. Vediamo cosa succede nell’equazione del calcolo di AG.
AG = Cationi – Anioni = (Na+ + K+) – (Cl– + HCO3–) = (140 + 4) – (114+15) = 15 (vn < 12-16)
L’acidosi metabolica a GAP normale (o ipercloremica) è dovuta ad una perdita di bicarbonati:
- Perdita gastroenterica di HCO3– (diarrea, ureteroenterostomia, fistola pancreatica)
- Perdita renale di HCO3– (acidosi tubulare renale, iperparatiroidismo, inibitori dell’anidrasi carbonica)
- Ipoaldosteronismo
- Somministrazione di grandi quantità di soluzione fisiologica (NaCl): l’aumento di cloro dermina perdita di bicarbonato per garantire l’elettroneutralità.
In caso di alcalosi metabolica, disturbo caratterizzato da una perdita di [H+] o da un aumento di HCO3–, l’organismo reagisce trattenendo, nel limite del possibile acidi volatili, cioè pCO2, mediante una diminuzione della ventilazione. Questo meccanismo è stabile e non prevede una fase cronica del compenso, come accade a livello renale.
L’alcalosi metabolica trova le sue cause nelle seguenti condizioni:
- somministrazione di bicarbonato (milk-alcali sindrome, somministrazione di HCO3– e.v.)
- VCE (volume extracellulare) ridotto: vomito, SNG, adenoma villoso, diuretici, stati edematosi
- VCE aumentato: iperaldosteronismo, cushing, liquirizia
- Cause genetiche (Liddle, Bartter, Gitelman)
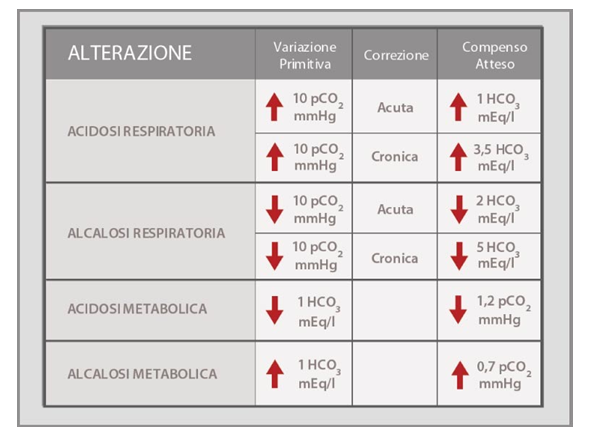
Per finire ecco un breve riassunto dei valori di riferimento fisiologici dei parametri di una emogasanalisi (ho incluso anche i parametri di quella venosa).

Purtroppo a causa della lunghezza e complessità dell’argomento non è possibile in questo articolo, che difatti ha lo scopo di essere una guida base sull’interpretazione dell’EGA, approfondire sulla miriade di variabili dei disturbi misti che si possono incontrare nell’ampia casistica di pazienti che giornalmente ognuno di noi deve assistere; però sono molto fiducioso che questo possa essere un inizio sul fornire solide basi che consentano di capire un po’ di più il significato di un’emogasanalisi e più ampiamente l’affascinante mondo dell’equilibrio acido-base e del funzionamento del nostro organismo.
Stefano Cellari
Bibliografia
- Marino PL. 2014. The ICU Book IV Edizione.
- Larsen R, Ziegenfub T. 2006. La respirazione artificiale.
- Kette F, Schisaldi F. Emogasanalisi, fluidi ed elettroliti. IRC
Scopri come guadagnare pubblicando la tua tesi di laurea su NurseTimes
Carica la tua tesi di laurea: tesi.nursetimes.org










Lascia un commento