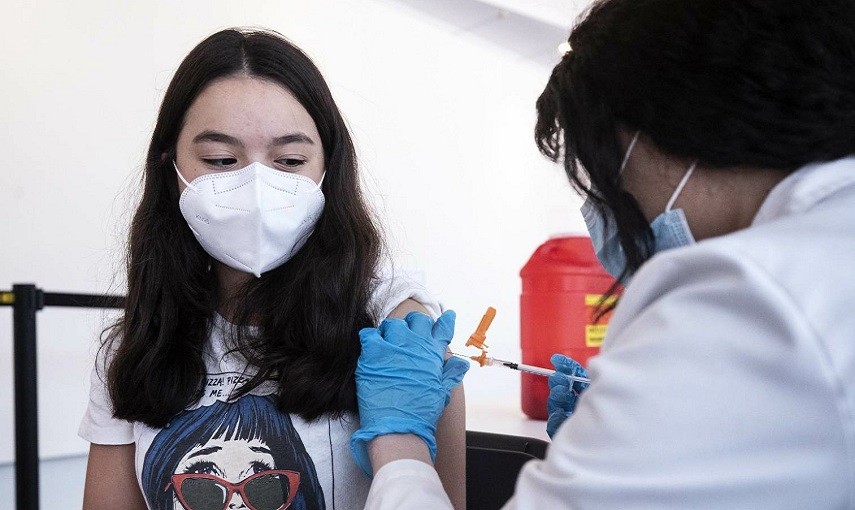
Accolto il parere dell’Ema. Secondo la Commissione tecnico scientifica dell’Agenzia Italiana del Farmaco, i dati disponibili dimostrano l’efficacia e la sicurezza del vaccino anche per gli adolescenti.
La Commissione tecnico scientifica (Cts) dell’Aifa ha approvato l’estensione dell’indicazione di utilizzo del vaccino Comirnaty (BioNTech/Pfizer) per la fascia di età tra i 12 e i 15 anni, accogliendo pienamente il parere espresso dall’Agenzia europea dei medicinali (Ema). I farmaci, fanno sapere le due società, sono stati tollerati bene dagli adolescenti, senza particolari eventi avversi e senza l’insorgenza di effetti collaterali non conosciuti. Tutti i volontari saranno monitorati per due anni dopo la seconda dose.
La richiesta delle aziende di estendere l’autorizzazione è stata supportata dai dati di uno studio di fase 3 su 2.260 giovani tra i 12 e i 15 anni. I risultati principali riportati a marzo hanno dimostrato che Comirnaty, noto anche come BNT162b2, ha innescato “robuste risposte anticorpali” ed è stato efficace al 100% nel proteggere dalla malattia, indipendentemente dal fatto che i partecipanti avessero precedentemente contratto l’infezione da SARS-CoV-2 o meno. Gli effetti collaterali erano anche generalmente coerenti con quelli osservati nelle persone dai 16 ai 25 anni di età.
Il vaccino Pfizer/BioNTech è stato il primo a ricevere l’approvazione condizionata all’uso nell’Unione Europea e il primo per cui l’autorizzazione è stata estesa anche ai ragazzi dalla seconda media in su. Rendere i vaccini disponibili agli adolescenti, infatti, permette la riapertura in sicurezza delle scuole, spianando la strada per l’agognato ritorno alla normalità. In Italia, secondo l’Aifa, sono 8,5 milioni i giovani pazienti che potranno ricevere il farmaco. Come ha dichiarato il generale Figliuolo, sono già stati inseriti all’interno del piano vaccinale e i genitori potranno iscriverli già nei primi dieci giorni di giugno.
Intanto uno studio pediatrico sta valutando la sicurezza e l’efficacia del vaccino anti-Covid Pfizer/BioNTech nei bambini dai 6 mesi agli 11 anni, nonostante le pesanti critiche e un preciso appello dell’Oms. Le due case farmaceutiche sono in attesa dei primi risultati, che saranno sottoposti alla valutazione dell’Ema in due fasi, con tre valutazioni differenti. Per le fasce di età dai 2 ai 5 anni e dai 5 agli 11 anni la richiesta all’Agenzia europea dovrebbe avvenire a settembre 2021. Per la fascia di età dai 6 mesi ai 2 anni la richiesta dovrebbe avvenire negli ultimi tre mesi dell’anno.
Redazione Nurse Times









Lascia un commento