Nuovi dispositivi impiantabili tipo “Optimizer Smart”, assistenza infermieristica
…di Antonio Savino
Competenze e complessità
Partiamo dal significato generale di competenza, da cui ne deriva che è la migliore prestazione all’interno di una professione, la capacità di dominare il contesto, qualsiasi esso sia.
Parlare di competenza Infermieristica significa considerare le ABILITA’ necessarie alla realizzazione del processo di assistenza, capacità di osservazione, pianificazione e valutazione, di decisione, di esecuzione delle prestazioni assistenziali più appropriate e sicure, nonché supportate dalle migliori prove di efficacia.
Fondamentale ai fini della valutazione, la definizione di codifica dei risultati ottenuti attraverso strumenti che identifichino la qualità dell’assistenza percepita ed erogata.
Nell’Unità Operativa di Cardiologia l’attività infermieristica è molto specifica, la competenza è un processo lungo e comprende impegno scientifico culturale, oltre che di esperienza continua.
Il Servizio di Cardiologia Interventistica (SCI) è parte integrante della Struttura Complessa di Cardiologia e comprende il Servizio di Emodinamica ed Elettrofisiologia.
Con il proporsi di nuove tecnologie per l’infermiere di Cardiologia Interventistica ed elettrostimolazione diventa sempre più complesso l’approccio assistenziale. Egli deve acquisire insieme alle conoscenze tecniche altamente specialistiche, anche capacità operativa individuando i propri ambiti di autonomia.
Dal punto di vista operativo il medico è l’operatore principale, tuttavia la collaborazione e la gestione assistenziale del paziente prima, durante e dopo l’interventistica è a carico dell’infermiere.
Dal punto di vista assistenziale l’impianto di nuovi disposti come “OPTIMIZER SMART” (Cardiac Contractility Modulation o Modulatore di contrattilità cardiaca), vede la tecnica classica di un impianto di ICD o PMK con la differenza che il dispositivo è impiantabile come un comune pacemaker bicamerale, solo che la terapia viene rilasciata da due normali elettrocateteri a vite posizionati sul setto interventricolare destro, distanziati tra loro di almeno 1 cm.
Di seguito la procedura assistenziale all’impianto
Il giorno dell’impianto
L’infermiere di reparto, il giorno di posizionamento di un impianto di dispositivo impiantabile cardiaco:
- compila e controlla che tutta la documentazione necessaria sia presente, compilata e correttamente allegata in CC (consensi informati, check list, ecc..)
- verifica la presenza di braccialetto identificativo
- verifica la pervietà del catetere venoso periferico.
- verifica che il paziente abbia eseguito una corretta igiene cutanea e in caso contrario esegue igiene, che il paziente abbia svuotato la vescica prima di scendere in sala di elettrostimolazione.
- rimuove accessori, monili e protesi del paziente e li conserva accuratamente
- sveste il paziente facendogli indossare i dpi monouso: camice, cuffia, calzari.
- esegue se richiesto il prelievo ematico di controllo
- rileva i parametri vitali e li documenta in CC.
- somministra la terapia come da prescrizione, verifica la presenza di ansia e verifica con il medico la necessità di somministrare eventuali ansiolitici/sedativi.
- esegue tricotomia del torace e della regione ascellare sulla sede prevista.
- accompagna in sala operatoria il paziente in barella o predispone il trasferimento in sicurezza.
Ciò che cambia rispetto agli altri dispositivi impiantabili (PMK, ICD…) è l’assenza di controllo periodico dell’apparecchio impiantato.
Essendo una procedura di tipo chirurgico l’inquadramento dei locali, i comportamenti, le regole ed i controlli che vengono effettuati sono riconducibili ai locali classificati in area chirurgica.
Ne deriva che all’infermiere di Cardiologia interventistica/elettrostimolazione vengono richieste sempre nuove capacità assistenziali e la conoscenza di nuovi dispositivi. L’infermiere oggi è un professionista completo che ha le capacità tecniche e assistenziali atte ad ottenere il miglior risultato possibile per le procedure interventistiche anche per dispositivi di nuova generazione.
Nello specifico conosciamo il nuovo dispositivo per lo scompenso cardiaco, Cardiac Contractility Modulation (Modulatore di contrattilità cardiaca),
Descrizione
Il dispositivo medico denominato OPTIMIZER SMART (ditta Impulse Dynamics) costituisce un’importante innovazione tecnologica per la cardiologia relativamente al trattamento dello scompenso cardiaco.
Il Generatore di impulsi impiantabile (IPG) OPTIMIZER Smart è un dispositivo programmabile con batteria interna e funzioni di telemetria. Il sistema è adatto al trattamento dell’insufficienza cardiaca; monitora l’attività intrinseca del cuore e invia segnali di modulazione cardiaca della contrattilità (CCM) durante il periodo refrattario assoluto ventricolare. L’invio del segnale CCM è sincronizzato con l’attività elettrica locale rilevata. Questa programmabilità dell’IPG OPTIMIZER Smart implica che il personale medico possa personalizzare i parametri di funzionamento secondo i requisiti individuali di ciascun paziente con il Programmatore OMNI Smart. L’IPG OPTIMIZER Smart è alimentato da una batteria ricaricabile, che può essere ricaricata per via sottocutanea mediante trasferimento dell’alimentazione induttiva con il Mini-caricatore OPTIMIZER.
Il dispositivo, come precedentemente detto invia al cuore segnali di Modulazione della Contrattilità Cardiaca. Tale trattamento è utile per pazienti con insufficienza cardiaca da moderata a grave (NYHA classe II-IV). L’uso a breve e lungo termine di questa terapia migliora sia la forza della contrazione ventricolare, che la capacità di pompaggio del cuore modulando la contrattazione del miocardio. Il meccanismo CCM è basato sulla stimolazione del muscolo cardiaco con segnali elettrici non eccitatori.

Nella terapia CCM, la stimolazione elettrica viene applicata al muscolo cardiaco durante il periodo di refrattario assoluto. In questa fase i segnali elettrici CCM attivano la mobilizzazione di ioni di calcio nei cardiomiociti. [4] [5] Una meta-analisi nel 2014 [2] e una panoramica delle opzioni di trattamento basate su dispositivi in caso di insufficienza cardiaca nel 2013 [1] hanno concluso che il trattamento CCM è sicuro, [1] [9] che generalmente è vantaggioso per i pazienti [1] 9] e che il trattamento CCM aumenta la tolleranza all’esercizio (ET) e la qualità della vita (QoL) dei pazienti [2].
Inoltre, i dati preliminari di sopravvivenza a lungo termine mostrano che CCM è associato a una mortalità a lungo termine inferiore nei pazienti con insufficienza cardiaca se confrontata con i tassi attesi tra i pazienti simili non trattati con CCM [10].
Il meccanismo di azione della CCM è stato oggetto di ricerche continue dalla sua scoperta iniziale. Sulla base dei test sugli animali e degli esperimenti su tessuto miocardico umano ottenuti da biopsie, sono state identificate parti essenziali del meccanismo di azione [4] [38] Secondo la comprensione attuale, il meccanismo di azione del CCM può essere sintetizzato nel modo seguente: I segnali CCM applicati durante il periodo refrattario assoluto causano un aumento del calcio nel citosol durante la sistole. Ciò aumenta la forza di contrazione muscolare.
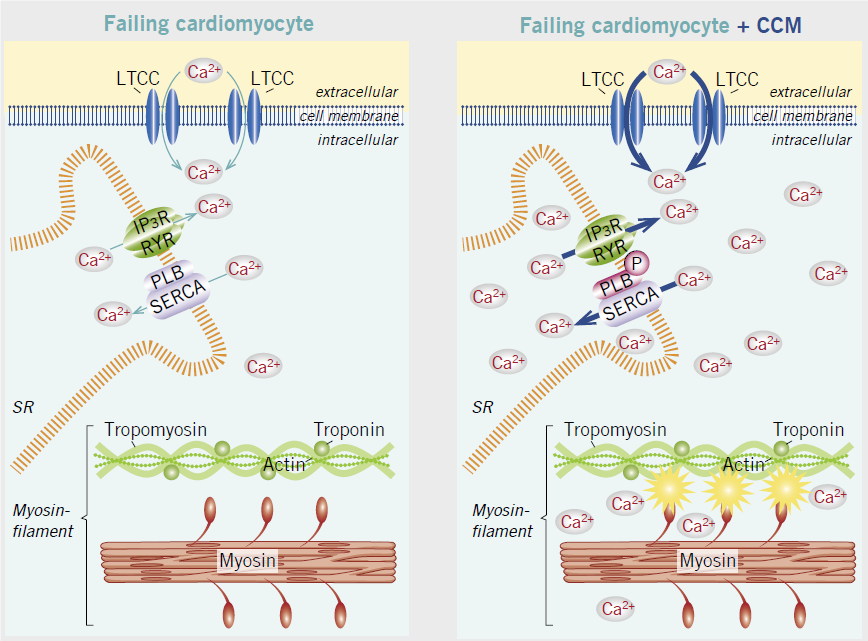
Entro vari secondi dall’applicazione della terapia si verifica la normalizzazione dell’attività delle proteine che vengono coinvolte nella regolazione del calcio intracellulare. Dopo alcune ore di applicazione si assiste ad una normalizzazione progressiva dell’espressione anomala del programma genico fetale caratteristica dell’insufficienza cardiaca [38]. Inoltre già entro 3 mesi è stato dimostrato un rimodellamento inverso con riduzione dello stress meccanico e neurormonale ed aumento della frazione di eiezione del ventricolo sinistro.
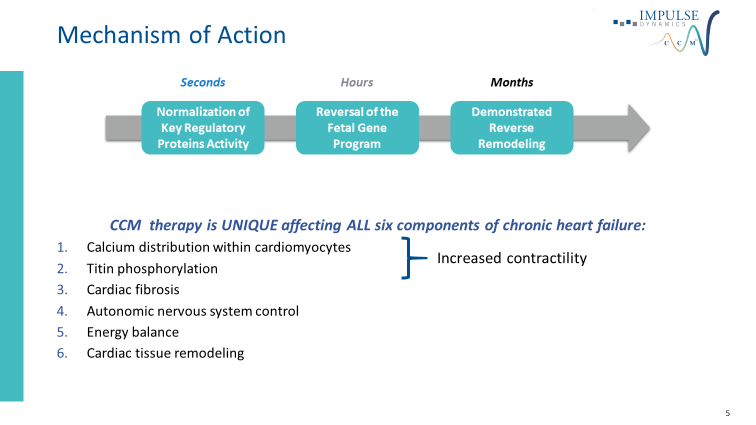
Questo effetto benefico avviene inizialmente solo nell’area adiacente agli elettrodi, ma con il tempo si diffonde anche in aree remote del muscolo cardiaco. [38] CCM ripristina quindi la struttura e la funzione delle cellule danneggiate verso il loro normale stato. In alcuni casi, le alterazioni legate alla malattia nella struttura cardiaca ventricolare possono essere in parte invertite dal CCM attraverso un processo noto come rimodellamento inverso del cuore [3] [4] [5] [16] [39] [40].
Indicazioni Terapeutiche
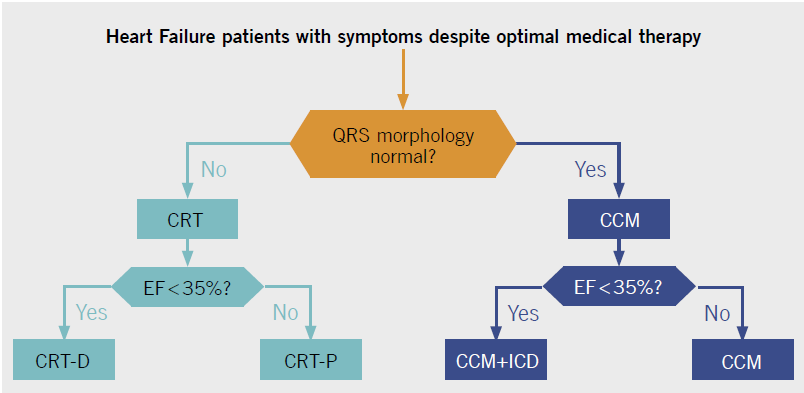
La maggior parte degli studi clinici sulla terapia con CCM hanno coinvolto pazienti con insufficienza cardiaca che sono stati classificati inizialmente come NYHA Classe II, III o IV e avevano una durata normale QRS (durata QRS ≤ 120 ms).
Un successivo studio di valutazione (analisi di sottogruppi) ha suggerito un particolare gruppo di pazienti che risponde eccezionalmente bene alla terapia con CCM. I pazienti sono stati caratterizzati da una gravità della malattia di NYHA classe III e da una frazione di eiezione del ventricolo sinistro ≥ 25%. [1] [14].
Tali risultati sono stati marcati dallo studio randomizzato e prospettico FIX HF-5-C di Abraham ed al. [54] che ha valutato in un Fu di 6 mesi la CCM + terapia ottimizzata versus gruppo con solo terapia ottimizzata in pazienti con classe NYHA III-IV (non end-stage), ritmo sinusale, QRS minore di 130 ms e frazione di eiezione tra 25% e 45%. Tale studio valutava la differenza tra i due gruppi della capacità funzionale, la qualità della vita e la classe NYHA, oltre alla sicurezza della procedura interventistica.
I risultati hanno evidenziato che a 6 mesi la CCM migliora significativamente la capacità funzionale e la differenza tra i due gruppi (trattamento + terapia medica ottimizzata vs solo terapia medica ottimizzata) era statisticamente significativa. Anche per quanto riguarda la QOL e il miglioramento della classe NYHA erano a favore del gruppo di trattamento. La sicurezza della procedura era pari al 89,7% e per quanto riguarda la riduzione del tasso di eventi avversi c’è stata una riduzione relativa del 56% a favore del gruppo CCM. Anche per quanto riguarda le ospedalizzazioni c’è stato una riduzione relativa del 73% a favore del gruppo con CCM. Il sottogruppo di pazienti con FE tra il 35% e 45% ha dimostrato che i benefici clinici erano più evidenti.
Dopo la pubblicazione di Abraham la FDA ha approvato la terapia CCM tramite il dispositivo Optmizer Smart come terapia in pazienti con scompenso cardiaco sistolico con QRS normale [55].
Sebbene gli studi sulla terapia CCM siano stati focalizzati su pazienti con una durata normale di QRS (≤ 120 ms), è possibile utilizzare il CCM in pazienti che soddisfano l’indicazione del trattamento ma che non hanno una durata normale di QRS [3] [16]. Uno studio pubblicato al inizio del 2019, ha valutato la applicazione della CCM in pazienti che non hanno risposto alla terapia di resincronizzazione cardiaca (CRT). Oltre ad essere sicuro ed efficace (come dimostrato in uno studio preliminare precedente [17]), la CCM migliora a 6 mesi gli outcome clinici in termini di tolleranza al esercizio e di QOL [56].
Le recenti linee guida ESC pubblicate 2016 [57] e la Consensus HFA ESC 2019 indicano che la terapia CCM è stata valutata in pazienti con HFrEF in Classe NYHA II-IV con normale durata QRS (<120 ms) e affermano che la CCM può essere considerato in pazienti selezionati con HF [58].
Impatto del Dispositivo medico sui principali indicatori di esito (mortalità, morbilità, altro) e su aspetti di tipo umanistico (qualità della vita, soddisfazione degli utenti)
La pubblicazione internazionale Giallauria et al. ha valutato i tre trial randomizzati controllati (RCT) attualmente disponibili sulla terapia CCM relativamente al trattamento per i pazienti con insufficienza cardiaca [2]. I tre studi hanno incluso un totale di 641 pazienti e hanno valutato l’effetto del CCM sia in confronto ad un trattamento vs Placebo [22] [23], sia rispetto al miglior trattamento medico [24]. A differenza di una precedente meta-analisi di Kwong et al. [25] lo studio non ha valutato i dati basati su risultati di sintesi da soli, ma sulla base dei singoli set di dati dei 641 pazienti iscritti.
Lo studio ha concluso che CCM ha significativamente migliorato i marcatori importanti della prestazione cardiaca. Questi includono l’assorbimento massimo dell’ossigeno (picco VO2 o pVO2 – misurato dai parametri ventilatori durante un esercizio cardiopolmonare), indicando una migliore sopravvivenza [29] e il test a 6 minuti. La qualità della vita dei pazienti partecipanti, misurata anche dal questionario Minnesota Living with Heart Failure Questionnaire (MLWHFQ), è anche migliorata significativamente.
Giallauria et al. descrivono il successo della modulazione cardiaca di contrattilità e l’ulteriore potenziale della terapia. Particolare enfasi è data alla possibilità che la terapia con CCM possa chiudere il divario terapeutico nel trattamento di insufficienza cardiaca se sono confermati i risultati di studio precedenti.
Trattandosi di una tecnologia ancora relativamente nuova l’effetto della CCM sui tassi di mortalità a lungo termine dei pazienti con insufficienza cardiaca non è stato studiato in uno studio controllato randomizzato.
Tuttavia però alcuni studi preliminari su singolo centro sono stati segnalati. [10] Kuschyk et al. ha valutato l’efficacia a lungo termine e la sopravvivenza dei pazienti con CCM [10]. La loro analisi comprendeva 81 pazienti con una gravità della malattia di NYHA classe II, III o IV e un follow-up medio di circa 3 anni. L’analisi ha confrontato il tasso di mortalità osservato con la previsione del gruppo globale Meta-analisi nel modello di insufficienza cardiaca cronica (MAGGIC) [30] [31] che si basa sui record di oltre 39.000 pazienti con insufficienza cardiaca. A differenza di un precedente studio a lungo termine del CCM [32], questo studio non è stato limitato da un gruppo di pazienti molto eterogeneo. Dopo un’osservazione a lungo termine, lo studio ha concluso che il CCM ha migliorato la qualità della vita, la tolleranza all’esercizio, la classe NYHA, la frazione di evacuazione ventricolare sinistra (LVEF) e i livelli di peptide natriuretico del cervello (BNP). I tassi di mortalità erano significativamente inferiori a quelli previsti all’anno 1 e sono inferiori a quelli previsti.
Anche con il registro multicentrico di Anker et al, è stato valutato in un Fu di 3 anni su 140 pazienti con FE tra 25% e 45% impiantati da ottobre 2013 e seguiti fino al ottobre 2017 l’impatto a lungo termine della CCM gli outcome clinici e di sopravvivenza [59].
I risultati hanno evidenziato che la CCM migliora l’outcome clinico in termini di tolleranza al esercizio e di QOL e migliora la sopravvivenza a lungo termine confrontata con la mortalità predetta dal SHFM score e riduce le ospedalizzazioni del 75%. Nella fattispecie, i pazienti con frazione di eiezione tra il 35% e 45% hanno una sopravvivenza predetta notevolmente a favore della CCM rispetto al gruppo con FE minore del 35% ed il tasso di ospedalizzazioni si riduce al 80%. Ciò ha confermato i risultati già evidenziati nello studio di Abraham.
Dott. Inf. Antonio Savino, UOC Cardiologia Universitaria, Uoc Cardiologia Interventistica, UOSD Elettrostimolazione presso l’Azienda Ospedaliera “S. Anna E S. Sebastiano” Di Caserta
Riferimenti Bibliografici
- Abraham, W.T.; S.A. Smith (Feb 2013). “Devices in the management of advanced, chronic heart failure” (PDF). Nat Rev Cardiol. 10 (2): 98–110. doi:10.1038/nrcardio.2012.178. PMC 3753073 . PMID 23229137. Retrieved Oct 10, 2014.
- Giallauria, F.; et al. (Aug 2014). “Effects of cardiac contractility modulation by non-excitatory electrical stimulation on exercise capacity and quality of life: an individual patient’s data meta-analysis of randomized controlled trials”. Int J Cardiol. 175 (2): 352–357. doi:10.1016/j.ijcard.2014.06.005. PMID 24975782.
- Borggrefe, M.; D. Burkhoff (Jul 2012). “Clinical effects of cardiac contractility modulation (CCM) as a treatment for chronic heart failure”. Eur J Heart Fail. 14 (7): 703–712. doi:10.1093/eurjhf/hfs078. PMID 22696514.
- Butter, C.; et al. (May 2008). “Cardiac Contractility Modulation Electrical Signals Improve Myocardial Gene Expression in Patients With Heart Failure” (PDF). J Am Coll Cardiol. 51 (18): 1784–1789. doi:10.1016/j.jacc.2008.01.036. PMID 18452785. Retrieved Oct 9, 2014.
- Yu, C.M.; et al. (Dec 2009). “Impact of cardiac contractility modulation on left ventricular global and regional function and remodeling” (PDF). JACC Cardiovasc Imaging. 2 (12): 1341–1349. doi:10.1016/j.jcmg.2009.07.011. PMID 20083066. Retrieved Oct 10, 2014.
- Marcus, Melvin L. (1983). The Coronary Circulation in Health and Disease. McGraw Hill. ISBN 978-0070402935.
- Butter, C.; et al. (Mar 2007). “Enhanced inotropic state of the failing left ventricle by cardiac contractility modulation electrical signals is not associated with increased myocardial oxygen consumption”. J Card Fail. 13 (2): 137–142. doi:10.1016/j.cardfail.2006.11.004. PMID 17395055.
- Goliasch, G.; et al. (Mar 2012). “The effect of device-based cardiac contractility modulation therapy on myocardial efficiency and oxidative metabolism in patients with heart failure”. Eur J Nucl Med Mol Imaging. 39 (3): 408–415. doi:10.1007/s00259-011-1977-8. PMID 22083298.
- Tönnis, T.; Kuck, K.-H. (Oct 2011). “Therapie der chronischen Herzinsuffizienz durch kardiale Kontraktionsmodulation (CCM) Möglichkeiten und Studienübersicht”. Herz. 36 (7): 600–607. doi:10.1007/s00059-011-3510-z. PMID 21912910.
- Kuschyk, J.; et al. (Jan 2015). “Efficacy and survival in patients with cardiac contractility modulation: Long-term single center experience in 81 patients”. Int J Cardiol. 183: 76–81. doi:10.1016/j.ijcard.2014.12.178. PMID 25662055.
- Kuschyk, J. (2014). “Der Besondere Stellenwert der Kardialen Kontraktilitätsmodulation in der Devicetherapie”. Herzmedizin. Retrieved Jun 6, 2014.
- clinicaltrials.gov Announcement of a study that will further investigate safety and efficacy of CCM devices
- Kuck, K.-H.; et al. (Jan 2014). “New devices in heart failure: an European Heart Rhythm Association report: developed by the European Heart Rhythm Association; endorsed by the Heart Failure Association” (PDF). Europace. 16 (1): 109–128. doi:10.1093/europace/eut311. PMID 24265466. Retrieved Oct 13, 2014.
- Abraham, W.T.; et al. (Sep 2011). “Subgroup Analysis of a Randomized Controlled Trial Evaluating the Safety and Efficacy of Cardiac Contractility Modulation in Advanced Heart Failure”. J Card Fail. 17 (9): 710–717. doi:10.1016/j.cardfail.2011.05.006. PMID 21872139.
- Burkhoff, D. (Dec 2011). “Does Contractility Modulation Have a Role in the Treatment of Heart Failure?”. Curr Heart Fail Rep. 8 (4): 260–265. doi:10.1007/s11897-011-0067-3. PMID 21656201.
- Butter, C. (Mar 2011). “Verbesserung der linksventrikulären Kontraktilität durch Stimulation in der absoluten Refraktärperiode. Kardiale Kontraktilitätsmodulation.”. Herzschr Elektrophys. 22 (1): 27–33. doi:10.1007/s00399-011-0120-7. PMID 21365468.
- Nagele, H.; S. Behrens; C. Eisermann (Dec 2008). “Cardiac contractility modulation in non-responders to cardiac resynchronization therapy” (PDF). Europace. 10 (12): 1375–1380. doi:10.1093/europace/eun257. PMID 18776196. Retrieved Oct 11, 2014.
- McMurray, J.J.V.; et al. (2012). “ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012” (PDF). European Heart Journal. 33 (14): 1787–1847. doi:10.1093/eurheartj/ehs104. PMID 22611136. Retrieved Oct 10, 2014.
- Röger, S.; et al. (Aug 2014). “Long term impact of cardiac contractility modulation on QRS duration”. J Electrocardiol. 47: 936–40. doi:10.1016/j.jelectrocard.2014.08.011. PMID 25201417.
- ESC National Cardiac Societies endorsing ESC guidelines on the Website of the ESC Archived April 25, 2013, at the Wayback Machine.
- Coats, A.J.S.; L.G. Shewan (Oct 2013). “Inconsistencies in the development of the ESC Clinical Practice Guidelines for Heart Failure”. Int J Cardiol. 168 (3): 1724–1727. doi:10.1016/j.ijcard.2013.05.045. PMID 23735338.
- Neelagaru, S.B.; et al. (Oct 2006). “Nonexcitatory, cardiac contractility modulation electrical impulses: Feasibility study for advanced heart failure in patients with normal QRS duration”. Heart Rhythm. 3 (10): 1140–1147. doi:10.1016/j.hrthm.2006.06.031. PMID 17018340.
- Borggrefe, M.; et al. (Apr 2008). “Randomized, double blind study of non-excitatory, cardiac contractility modulation electrical impulses for symptomatic heart failure” (PDF). Eur Heart J. 29 (8): 1019–1028. doi:10.1093/eurheartj/ehn020. PMID 18270213. Retrieved Oct 16, 2014.
- Kadish, A.; et al. (Feb 2011). “A randomized controlled trial evaluating the safety and efficacy of cardiac contractility modulation in advanced heart failure”. Am Heart J. 161 (2): 329–337. doi:10.1016/j.ahj.2010.10.025. PMID 21315216.
- Kwong, J.S.; J.E. Sanderson; C.M. Yu (Sep 2012). “Cardiac contractility modulation for heart failure: a meta-analysis of randomized controlled trials”. Pacing Clin Electrophysiol. 35 (5): 1111–1118. doi:10.1111/j.1540-8159.2012.03449.x. PMID 22734676.
- Kuschyk, J.; S. Röger; M. Borggrefe (Oct 2014). “Kardiale Kontraktilitätsmodulation zur Behandlung der symptomatischen Herzinsuffizienz”. Der Kardiologe. 8 (5): 407–414. doi:10.1007/s12181-014-0595-7. Retrieved Dec 1, 2014.
- Kuschyk, J.; M. Borggrefe (2013). “Elektrische Therapie der Herzinsuffizienz”. Kardio up. 9 (1): 37–56. doi:10.1055/s-0032-1326192. Retrieved Nov 6, 2014.
- Research of the Pubmed data base for the search term “Cardiac Contractility Modulation” in the title of publications performed on Oct 16, 2014
- Pakarinen, S.; L. Oikarinen; L. Toivonen (Jan 2010). “Short-term implantation-related complications of cardiac rhythm management device therapy: a retrospective single-centre 1-year survey” (PDF). Europace. 12 (1): 103–108. doi:10.1093/europace/eup361. PMID 19914920. Retrieved Nov 6, 2014.
- Pocock, S.J.; et al. (May 2013). “Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies”. Eur Heart J. 34 (19): 1404–1413. doi:10.1093/eurheartj/ehs337. PMID 23095984. Retrieved Feb 20, 2015.
- “MAGGIC” Heart Failure Risc Calculator according to Pocock et al. Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies, Eur Heart J (2013) 34(19) 1404-1413 (linked above)
- Schau, T.; et al. (Apr 2011). “Long-term outcome of cardiac contractility modulation in patients with severe congestive heart failure” (PDF). Europace. 13 (10): 1436–1444. doi:10.1093/europace/eur153. PMID 21712286. Retrieved Feb 20, 2015.
- Tips by the American Heart Associuation “Living With Your Pacemaker”
- Röger, S.; et al. (Apr 2014). “Cardiac contractility modulation: first experience in heart failure patients with reduced ejection fraction and permanent atrial fibrillation”. Europace. 16: 1205–9. doi:10.1093/europace/euu050. PMID 24706089.
- Safety recommendations of the American Heart Association for patients with artificial pacemakers
- Safety recommendations of the American Heart Association for patients with implantable cardioverter defibrillators (ICDs)
- Dill, T. (Jul 2008). “Contraindications to magnetic resonance imaging” (PDF). Heart. 94 (7): 943–948. doi:10.1136/hrt.2007.125039. PMID 18552230. Retrieved Feb 22, 2015.
- Lyon, A.R.; M.A. Samara; D.S. Feldman (Oct 2013). “Cardiac contractility modulation therapy in advanced systolic heart failure”. Nat. Rev. Cardiol. 10 (10): 584–598. doi:10.1038/nrcardio.2013.114. PMID 23939481.
- Imai, M.; et al. (May 2007). “Therapy with cardiac contractility modulation electrical signals improves left ventricular function and remodeling in dogs with chronic heart failure” (PDF). J Am Coll Cardiol. 49 (21): 2120–2128. doi:10.1016/j.jacc.2006.10.082. PMID 17531662. Retrieved Oct 11, 2014.
- Gupta, R.C.; et al. (Feb 2009). “Cardiac Contractility Modulation Electrical Signals Normalize Activity, Expression, and Phosphorylation of the Na+-Ca2+ Exchanger in Heart Failure”. Journal of Cardiac Failure. 15 (1): 48–56. doi:10.1016/j.cardfail.2008.08.011. PMID 19181294.
- Mond, H.G.; Proclemer, A. (Aug 2011). “The 11th world survey of cardiac pacing and implantable cardioverter-defibrillators: calendar year 2009–a World Society of Arrhythmia’s project.”. Pacing Clin Electrophysiol. 34 (8): 1013–1027. doi:10.1111/j.1540-8159.2011.03150.x. PMID 21707667.
- Announcement of the launch of the OPTIMIZER IVs CCM device on Implantable-Device.com
- CCM device application draft
- Patent for CCM: Apparatus and method for controlling the delivery of contractility modulating non-excitatory signals to the heart
- Mohri, S.; et al. (May 2002). “Cardiac contractility modulation by electric currents applied during the refractory period” (PDF). Am J Physiol Heart Circ Physiol. 282 (5): H1642–H1647. doi:10.1152/ajpheart.00959.2001. PMID 11959626. Retrieved Oct 9, 2014.
- Antoni, H.; R. Jacob; R. Kaufmann (1969). “Mechanical response of the frog and mammalian myocardium to changes in the action potential duration by constant current pulses”. Pflugers Arch. 306 (1): 33–57. PMID 4975967.
- Wood, E.H.; R.L. Heppner; S. Weidmann (Mar 1969). “Inotropic effects of electric currents. I. Positive and negative effects of constant electric currents or current pulses applied during cardiac action potentials. II. Hypotheses: calcium movements, excitation-contraction coupling and inotropic effects.”. Circ Res. 24 (3): 409–445. doi:10.1161/01.RES.24.3.409. PMID 5766519. Retrieved Oct 9, 2014.
- Burkhoff, D.; et al. (Jan 2001). “Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo”. Heart Fail Rev. 6 (1): 27–34. PMID 11248765.
- Sabbah, H.N.; et al. (Jan 2001). “Cardiac contractility modulation with the impulse dynamics signal: studies in dogs with chronic heart failure”. Heart Fail Rev. 6 (1): 45–53. PMID 11248767.
- Pappone, C.; et al. (Jan 2001). “Electrical modulation of cardiac contractility: clinical aspects in congestive heart failure”. Heart Fail Rev. 6 (1): 55–60. PMID 11248768.
- Pappone, C.; et al. (Dec 2002). “Cardiac contractility modulation by electric currents applied during the refractory period in patients with heart failure secondary to ischemic or idiopathic dilated cardiomyopathy”. Am J Cardiol. 90 (12): 1307–1313. doi:10.1016/s0002-9149(02)02868-0. PMID 12480039.
- Stix, G.; et al. (Apr 2014). “Chronic electrical stimulation during the absolute refractory period of the myocardium improves severe heart failure” (PDF). Eur Heart J. 25 (8): 650–655. doi:10.1016/j.ehj.2004.02.027. PMID 15084369. Retrieved Oct 10, 2014.
- Bohdjalian, A.; et al. (Sep 2009). “Improvement in glycemic control by gastric electrical stimulation (TANTALUS) in overweight subjects with type 2 diabetes”. Surg Endosc. 23 (9): 1955–1960. doi:10.1007/s00464-008-0222-4. PMID 19067068.
- Abraham W.T et al “A Randomized Controlled Trial to Evaluate the Safety and Efficacy of Cardiac Contractility Modulation”. J Am Coll Cardiol HF 2018; doi.org/10.1016/j.jchf.2018.04.010
- https://www.fda.gov/media/123038/download;
- Kuschyk et al. “Cardiac Contractility Modulation treatment in patients with symptomatic heart failure despite optimal medical therapy and cardiac resynchronization therapy (CRT)” International Journal of Cardiology 277 (2019) 173-177 . doi:10.1016/j.ijcard.2018.10.086
- Ponikowski P et al. “2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure”. European Heart Journal (2016) 37, 2129–2200. doi:10.1093/eurheartj/ehw128;
- Petar M. Seferovic et al ” Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of The Heart Failure Association of the European Society of Cardiology”. doi:10.1002/ejhf.1531.
- Anker S.D. et al “Cardiac contractility modulation improves long-term survival and hospitalizations in heart failure with reduced ejection fraction “. European Heart Journal (2019). doi:10.1002/ejhf.1374














Lascia un commento