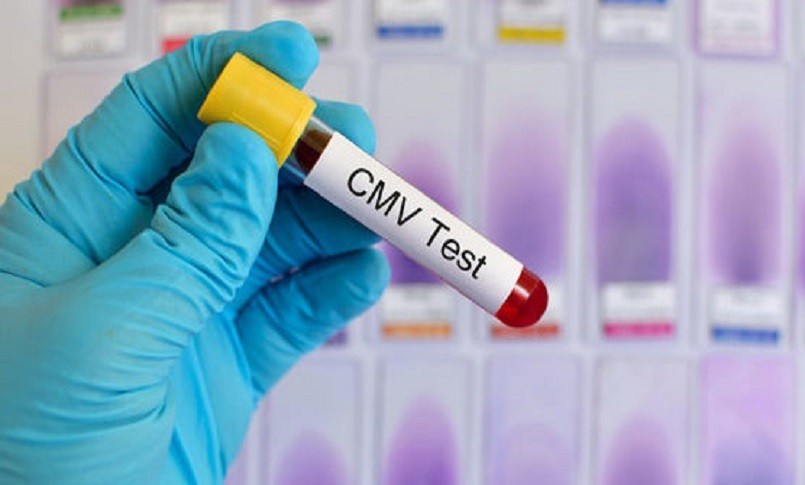
Si tratta del primo trattamento per pazienti con infezione post-trapianto che non rispondono agli antivirali.
L’americana Food and Drug Administration (Fda) ha approvato maribavir (Livtencity) come primo farmaco per il trattamento di pazienti adulti e pediatrici (a partire dai 12 anni di età e con un peso di almeno 35 kg) con infezione/malattia da citomegalovirus (CMV) post-trapianto che non rispondono (con o senza mutazioni genetiche che causano resistenza) al trattamento antivirale attualmente disponibile. Maribavir funziona impedendo l’attività dell’enzima pUL97 del citomegalovirus umano, bloccando così la replicazione del virus.
“I destinatari dei trapianti sono molto più a rischio di complicazioni e di morte di fronte a un’infezione da citomegalovirus – ha detto John Farley, direttore dell’Office of Infectious Diseases del Center for Drug Evaluation and Research dell’Fda –. Le infezioni da citomegalovirus resistenti o che non rispondono ai farmaci disponibili sono ancora più preoccupanti. L’approvazione di oggi aiuta a soddisfare un significativo bisogno medico insoddisfatto, fornendo un’opzione di trattamento per questa popolazione di pazienti”.
Il CMV è un tipo di herpes virus che causa comunemente l’infezione nei pazienti dopo un trapianto di cellule staminali o di organi. L’infezione può portare alla malattia e avere un forte impatto negativo sui destinatari del trapianto, compresa la perdita dell’organo trapiantato e la morte. La sicurezza e l’efficacia di maribavir sono state valutate in uno studio di fase 3, multicentrico, in aperto, controllato attivamente, che ha confrontato questo farmaco con un trattamento includente uno o due degli antivirali usati per trattare il CMV, ossia ganciclovir, valganciclovir, foscarnet e cidofovir. Nello studio 352 destinatari di trapianto con infezioni da CMV che non hanno risposto (con o senza resistenza) al trattamento hanno ricevuto in modo casuale maribavir o un trattamento assegnato da un ricercatore per un massimo di otto settimane.
Lo studio ha confrontato i livelli di concentrazione di CMV DNA nel plasma dei due gruppi alla fine dell’ottava settimana, con efficacia definita come avere un livello inferiore a quello misurabile. Dei 235 pazienti che hanno ricevuto maribavir, il 56% aveva livelli di CMV DNA inferiori a quelli misurabili, contro il 24% dei 117 pazienti che hanno ricevuto un trattamento assegnato dallo sperimentatore.
Gli effetti collaterali più comuni di maribavir includono disturbi del gusto, nausea, diarrea, vomito e affaticamento. Il farmaco può ridurre l’attività antivirale di ganciclovir e valganciclovir. Quindi la co-somministrazione con questi farmaci non è raccomandata. Il fallimento virologico dovuto alla resistenza può verificarsi durante e dopo il trattamento con maribavir. Pertanto i livelli di DNA del CMV devono essere monitorati e la resistenza di maribavir deve essere controllata se il paziente non risponde al trattamento o ha una ricaduta.
Redazione Nurse Times
- Stato-Regioni, Fials: “Documento condivisibile solo in parte. Forte preoccupazione sul Ddl professioni sanitarie”
- Atto di indirizzo 2026, la crisi degli infermieri mette a rischio la riforma del Ssn
- Sarcoma miogenico, all’Asst Gaetano Pini – CTO una protesi restituisce il futuro
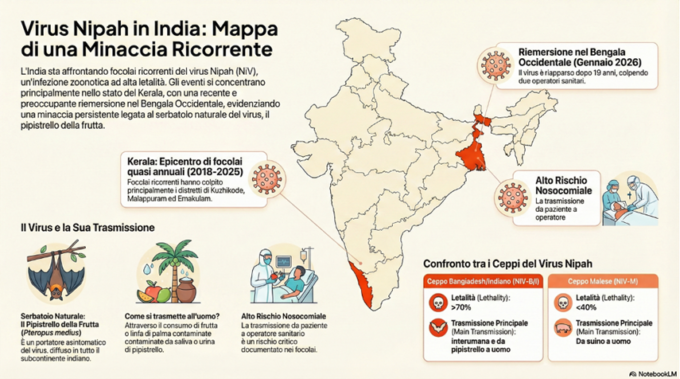
- Virus Nipah: dal focolaio in India ai protocolli di biocontenimento per la Provincia di Cuneo
- Punito perché caregiver: la denuncia dell’insegnante siciliano Francesco Malizia






Lascia un commento