La prossima settimana sarà chiamata a esprimersi sul tema anche l’Aifa. Intanto il ministero della Salute raccomanda la dose booster per over 18 ad almeno cinque mesi dal completamento del ciclo primario.
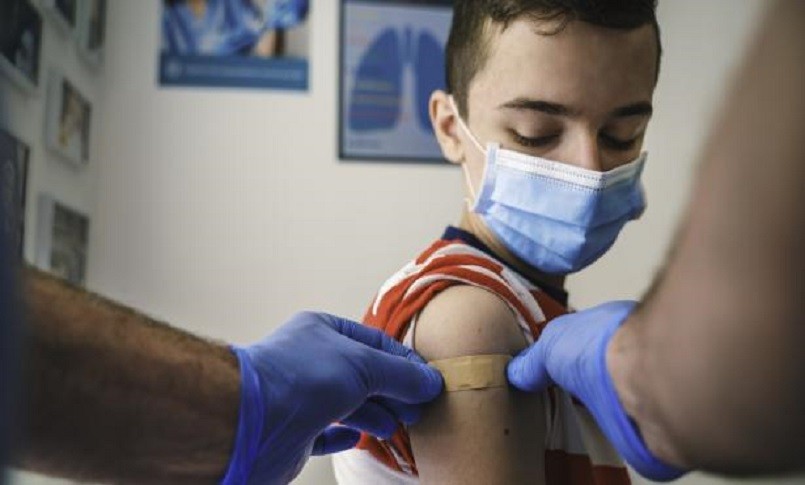
L’Ema ha raccomandato di concedere un’estensione dell’indicazione per il vaccino anti-Covid Pfizer-BioNtech ai bambini di età compresa tra 5 e 11 anni. Il vaccino è già approvato per l’uso in adulti e bambini dai 12 anni in su. Il Comitato per i medicinali a uso umano (Chmp) dell’Agenzia europea per i medicinali “ha concluso che i benefici nei bambini di età compresa tra 5 e 11 anni superano i rischi, in particolare in quelli con condizioni che aumentano il rischio di Covid grave”.
La raccomandazione, spiega l’Ema, si è basata sull’esame dei dati disponibili. Nel dettaglio, “uno studio principale su bambini di 5-11 anni ha mostrato che la risposta immunitaria a Comirnaty somministrato a una dose più bassa (10 µg) in questo gruppo d’età era paragonabile a quella osservata con la dose più alta (30 µg) in pazienti di età compresa tra 16 e 25 anni (misurata dal livello di anticorpi contro Sars-CoV-2)”.
L’efficacia di Comirnaty, ricorda sempre l’Agenzia, è stata calcolata in quasi 2mila bambini di età compresa tra 5 e 11 anni, che non presentavano segni di infezione precedente. Questi bambini hanno ricevuto il vaccino o un placebo (un’iniezione fittizia). Dei 1.305 bambini che hanno ricevuto il vaccino, tre hanno sviluppato Covid rispetto a 16 dei 663 bambini che hanno ricevuto il placebo. “Ciò significa che, in questo studio, il vaccino era efficace al 90,7% nel prevenire il Covid sintomatico (sebbene il tasso reale potesse essere compreso tra il 67,7% e il 98,3%)”.
Gli effetti indesiderati più comuni in questa fascia d’età “sono simili a quelli osservati nelle persone di età pari o superiore a 12 anni”, conferma l’Ema. Includono dolore al sito di iniezione, stanchezza, mal di testa, arrossamento e gonfiore al sito di iniezione, dolore muscolare e brividi. Questi effetti sono generalmente lievi o moderati e migliorano entro pochi giorni dalla vaccinazione.
La Commissione tecnico scientifica dell’Agenzia italiana del farmaco (Aifa) è stata convocata la prossima settimana, dal 1° al 3 dicembre: all’ordine del giorno anche la valutazione della pronuncia Ema. Intanto, secondo una circolare del ministero della Salute, a partire dal 1° dicembre 2021 “è raccomandata la somministrazione di una dose di vaccino a mRNA, come richiamo (booster) di un ciclo vaccinale primario, anche ai soggetti di età pari o superiore a 18 anni, nei dosaggi allo scopo autorizzati, indipendentemente dal vaccino utilizzato per il ciclo primario e purché sia trascorso un intervallo minimo di almeno cinque mesi (150 giorni) dal completamento dello stesso”.
Redazione Nurse Times
- Chierchia (Cisl Fp): “Sbigottiti dalle parole del presidente Fnomceo sugli infermieri. Sono il pilastro del Ssn”
- Caso Sara Pedri: nuove ricerche nel lago di Santa Giustina. La famiglia della ginecologa scomparsa nel 2021 spera ancora in un ritrovamento
- Assemblea annuale Opi Cosenza: tra bilanci e aggressioni agli operatori. Il presidente Sposato: “Infermieri fulcro della sanità”
- Caso Monaldi, Anelli (Fnomceo) scrive a Mangiacavalli (Fnopi): “Sincero rammarico. Rispetto e stima per la professione infermieristica”
- Caso Monaldi, Domenico restò senza cuore per almeno 45 minuti. L’Azienda: “Indagine interna avviata già il 30 dicembre”










Lascia un commento