Proponiamo un elaborato a cura di Domenico Dentico, Maria Teresa Burdi e Domenico Rutigliano
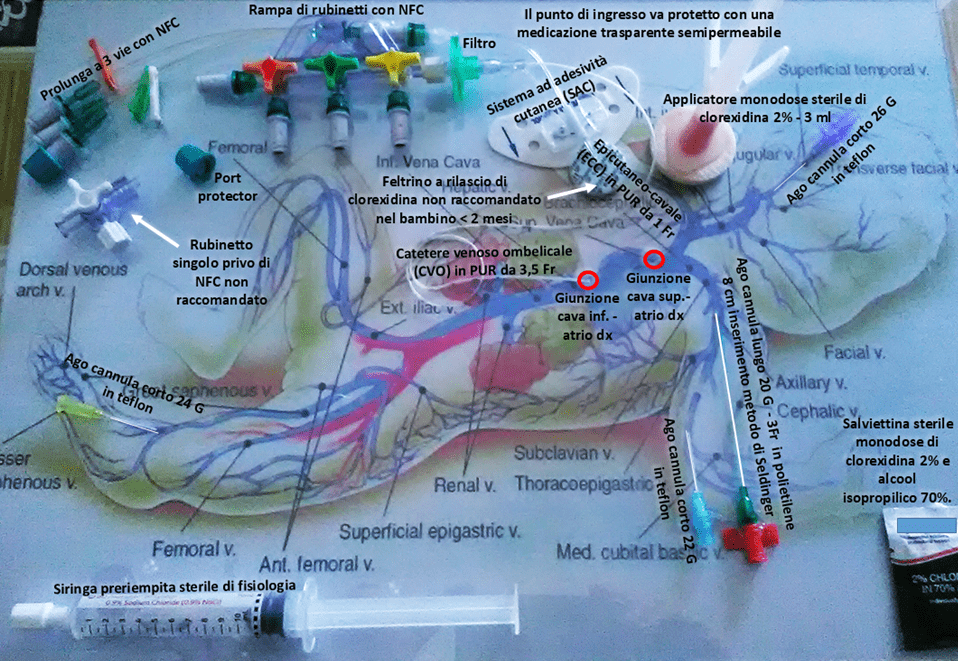
https://encrypted-tbn0.gstatic.com/images?q=tbn%3AANd9GcQeymAKfBxYmJ0j_GEgz9vUHy1bZ9zzmk9mCw&usqp=CAU realizzato dagli Autori, per offrire una visione d’insieme del bundle sugli accessi venosi per quanto attiene alle sedi di impianto, ai dispositivi vascolari, sia periferici che centrali, e ai devices per la gestione corretta della medicazione e delle linee infusionali.
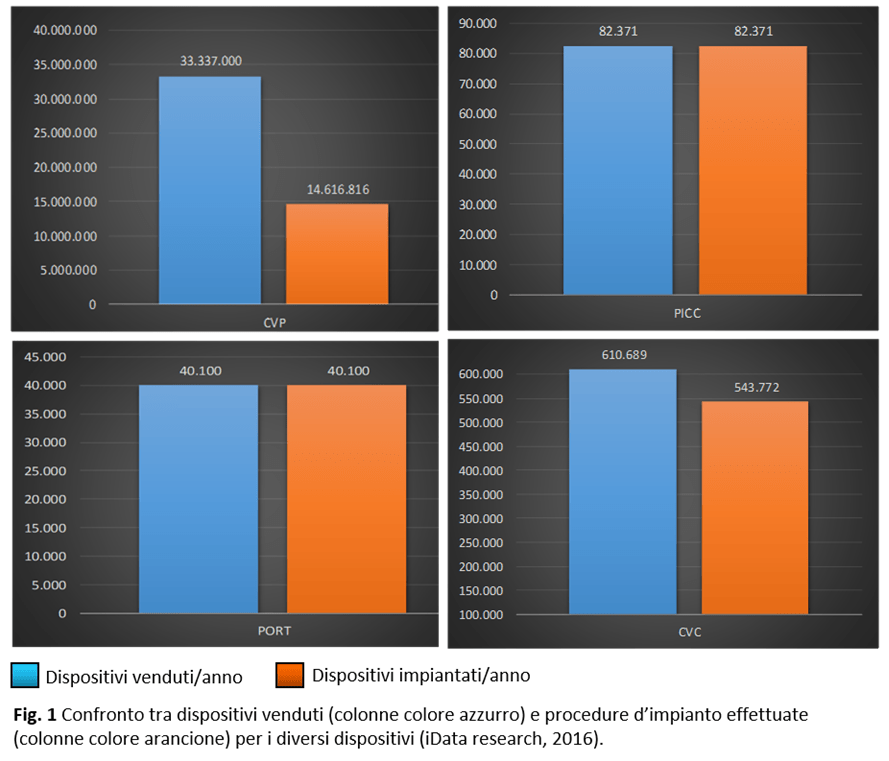
Lo scenario – In Italia si stima che ogni anno vengano impiantati circa 14 milioni di CVP (accessi venosi periferici), 82 mila PICC (catetere centrale a inserimento periferico), 40 mila PORT (catetere centrale totalmente impiantabile) e 540 mila CVC (cateteri venosi a inserzione centrale).
Il catetere venoso periferico è il dispositivo di accesso vascolare più utilizzato nei pazienti ricoverati.
Il 25% richiede tre o più tentativi per l’inserimento, per cui il numero di cateteri periferici effettivamente, venduti in un anno è di circa 33 milioni, a differenza dei cateteri PICC e PORT, che vengono impiantati nel 100% dei casi al primo tentativo. Un piccolo scostamento tra dispositivi venduti e quelli impiantati sussiste per i CVC.
Epidemiologia delle infezioni catetere-correlate
Secondo l’European Centre for Disease Prevention and Control (ECDC, 2011) il 32% delle infezioni ematiche, che rappresentano il 6,7% di tutte le Infezioni Correlate all’Assistenza (ICA), si presenta in soggetti portatori di device centrale; mentre lo 0,6% in soggetti a cui è stato impiantato un CVP.
I microrganismi più frequentemente responsabili di infezioni da catetere sono:
- Klebsiella pneumoniae (17,7%),
- Escherichia coli (13,5%),
- Pseudomonas aeruginosa e Acinetobacter baumannii (8,3%),
- Staphylococcus epidermidis (6,3%)
- Enterococcus faecalis (5,2%).
In Italia, ma i dati sono sovrapponibili a quelli europei, si stima che ogni anno il 10% dei pazienti contragga una infezione correlata all’assistenza (ICA), cioè 450-700.00 e circa 4-7.000 sono i morti in relazione ad essa.
L’incidenza di infezione legata al catetere vascolare è di 8.500 casi all’anno solo nelle terapie intensive e di questi il 20% è fatale (1.500 casi).
Si è calcolato che un singolo episodio di infezione catetere-correlata in terapia intensiva comporti un costo di circa 13.000 euro e un prolungamento medio della degenza di oltre 9 giorni.
Il costo totale delle infezioni da catetere per il Servizio Sanitario Nazionale è di circa 82 milioni di euro l’anno.
L’incidenza è, comunque, estremamente variabile da luogo a luogo e anche nello stesso ospedale; addirittura, da reparto a reparto, potendo andare da 0-2 episodi per 1000 giorni di permanenza catetere per i PICC, dati non ricavati, però, dal contesto delle terapie intensive, per cui l’incidenza potrebbe essere significativamente più alta.
I cateteri venosi ad inserzione centrale (CICC-FICC), invece, presentano una incidenza di infezioni ematiche catetere-correlata che varia dal 2,9 a 11,9 episodi per 1000 giorni di cateterismo.
Le complicanze
Le complicanze legate ai cateteri venosi centrali possono essere immediate se si manifestano durante la procedura di impianto; o subito dopo oppure tardive se si manifestano a distanza di tempo dall’impianto anche pochi giorni dopo.
Tra le principali complicanze immediate ricordiamo:
- lo pneumotorace,
- la puntura arteriosa accidentale,
- complicanze emorragiche,
- tentativi ripetuti,
- fallimento della manovra,
- aritmie,
- perforazione della cava o dell’atrio destro,
- malposizioni primarie (quando il catetere è stato impiantato in maniera scorretta),
- dolore durante l’inserzione
- lesione nervosa accidentale, come quella relativa al nervo mediano, che è la più temuta perché potrebbe comportare un grave danno funzionale del braccio.
Le complicanze tardive sono rappresentate:
- da infezioni,
- trombosi venosa,
- occlusioni,
- malposizioni secondarie (dislocazioni) e tip migration, cioè migrazione della punta del catetere che era stata, precedentemente, ben posizionata,
- lesione o rottura del catetere con stravaso di farmaci ed embolizzazione del catetere.
Vale la pena spendere qualche parola sulla embolizzazione, che è una complicanza rara, ma quando si verifica può essere pericolosa e grave.
Le cause dell’embolizzazione possono essere riferite a:
- Disconnessione di una parte del catetere nel caso di cateteri con connessione prossimale e impiantati in succlavia per via sottoclaveare. La rottura avviene, in genere, nel punto in cui il catetere passa tra clavicola e prima costa; dove si può intrappolare (fenomeno del pinch-off) tra le due strutture ossee, il muscolo sottoclaveare e il legamento costoclavicolare. Il catetere, in quella zona, può subire fenomeni di compressione, strofinamento e usura per i movimenti degli arti superiori e degli atti respiratori; che a lungo andare possono condurre alla rottura e all’embolizzazione. Se si vuole pungere, quindi, la vena succlavia è bene farlo; anche per evitare problemi di inginocchiamento del catetere (kinking), per via sovraclaveare e facendosi guidare ecograficamente.
- Rottura del catetere per eccessive pressioni di utilizzo e a tal proposito ricordiamo che più piccola è la siringa maggiore sarà la pressione esercitata all’interno del catetere.
- Trombosi settiche ed embolizzazione a distanza.
L’embolizzazione da disconnessione o rottura del catetere può determinare lo spostamento della porzione di catetere; che seguendo il flusso del sangue, può arrivare in atrio e ventricolo dx, in arteria polmonare e nelle ultime diramazioni del circolo polmonare.
Anche le trombosi venosa correlata alla presenza di un catetere rappresenta una temibile complicanza che potrebbe comportare embolia polmonare. L’infermiere deve tempestivamente individuare i segni e i sintomi di una trombosi venosa profonda (TVP) ed allertare il medico, che deve, poi, impostare una terapia adeguata.
I fattori di rischio possono riguardare il catetere (tipo di catetere, calibro, ecc…), il paziente (tipo di malattia predisponente alle trombosi, alterazioni del flusso sanguigno, sepsi, ecc…) o, spesso, entrambe le situazioni.
Per quanto riguarda i fattori di rischio legati al catetere e alla situazione locale ricordiamo la scelta errata della vena; il rapporto sproporzionato tra il calibro della vena e il calibro del catetere e la durezza dei materiali di costruzione.
La presenza del catetere in una vena, già di per sé, predispone alla trombosi venosa perché occupa spazio e rallenta il flusso ematico all’interno del vaso e il rischio aumenta in caso di utilizzo di cateteri di calibro maggiore.
Il rapporto ideale tra calibro esterno del catetere e calibro del vaso (misurato con ecografia e in caso di vene del braccio valutato senza laccio) è di 1/3 circa e considerando che 1 French (Fr) è uguale a 1/3 mm o che 3 Fr sono uguali a 1 mm possiamo affermare che il calibro della vena in mm è uguale al calibro del catetere in Fr e, quindi, in caso di vena da:
- 3 mm (9 Fr) è consigliabile utilizzare un PICC max di 3 Fr.
- 4 mm (12 Fr) è consigliabile utilizzare un PICC max di 4 Fr.
- 5 mm (15 Fr) è consigliabile utilizzare un PICC max 5 Fr.
E’ importante, per ridurre il rischio di trombosi, anche considerare altri aspetti come:
- Il posizionamento della punta, che deve essere posta a livello della giunzione cavo-atriale o al III inferiore della cava dove il tragitto è più rettilineo rispetto al III distale della vena cava sup. e neanche nella vena anonima o succlavia dove, a causa della fisiologica curvatura dei vasi, il flusso rallenta e la punta può urtare contro la loro parete.
- Il lato del posizionamento, perché si è visto che i cateteri impiantati sul lato sinistro danno più frequentemente trombosi rispetto a quelli impiantati sul lato destro, soprattutto per quanto riguarda la vena succlavia e la giugulare sinistra, che ha con l’anonima un angolo più pronunciato rispetto a quanto osservabile a destra, risultando, quindi, più trombogena. L’approccio a sinistra andrebbe quindi sempre considerato di seconda scelta.
- I materiali di costruzione del catetere. Esistono evidenze sulla minore trombogenicità dei cateteri in poliuretano di ultima generazione (power) rispetto al cateteri in silicone e in polietilene, questi ultimi, praticamente, abbandonati. La trombogenicità maggiore è associata ai materiali più rigidi e quindi più traumatici. I cateteri in poliuretano e in silicone possono avere lo stesso frenciaggio, ma quelli in silicone hanno un’area interna più piccola, perché la parete è più spessa; mentre quelli in poliuretano possiedono una parete più resistente e quindi più sottile, che determina un maggior flusso ematico.
- Anche il numero di lumi possono avere un ruolo nella trombogenicità perché, riducono, di fatto, il diametro interno.
- Un altro fattore è rappresentato dal numero di posizionamenti o tentativi di posizionamento di cateteri; che, nel tempo, possono provocare danni alla parete del vaso ed è per questo che si devono utilizzare gli aghi più delicati e sottili, che sono meno traumatici. E’ bene non trafiggere più volte la vena, ponendo attenzione ad evitare di pungere anche la sua parete posteriore. Per questo motivo l’introduttore-dilatatore, per i PICC, i CICC e i Midline, deve essere il più delicato e meno traumatizzante possibile (microintroduttori).
- Anche gli episodi di infezione correlata possono contribuire al determinismo degli eventi trombotici. La patogenesi del trombo sembra dipendere dalla maggiore adesività di alcuni batteri alle componenti del trombo stesso.
- Il rischio trombotico è maggiore se si utilizza la vena femorale rispetto alle vene degli arti superiori; proprio per il rallentamento del flusso e la presenza di valvole nelle vene dei distretti inferiori del corpo.
- L’arto paretico o fratturato, per riduzione o mancanza totale di movimento e dell’attività della pompa muscolare e del ritorno venoso, presenta, anche, una riduzione della circolazione del sangue. Non posizioneremo, mai, in questa sede, un catetere centrale e neanche una cannula periferica.
Segni e sintomi di trombosi venosa profonda:
- Malfunzionamento del sistema.
- Dolorabilità ai movimenti dell’arto e sensazione di intorpidimento.
- Dolore del lato dove è posizionato il catetere.
- Modificazioni del colorito cutaneo.
- Segni locali di stasi venosa (turgore e evidenza di circoli collaterali).
- Edema con rossore.
La più frequente complicanza, comunque, legata all’impianto e utilizzo dei presidi vascolari è rappresentata dall’infezione, che può essere distinta in locale e sistemica.
I cateteri periferici possono causare prevalentemente manifestazioni locali, come la flebite che si manifesta attraverso i segni classici dell’infiammazione cioè dolore, eritema, edema.
Negli stadi più avanzati con cordone palpabile e presenza di materiale purulento, meno frequentemente manifestazioni sistemiche, come la batteriemia (Blood-Stream Infection).
I cateteri centrali, invece, se mal posizionati e mal gestiti, possono condurre a batteriemie, a sepsi gravi e anche a morte.
Le batteriemie legate alla presenza di un catetere vascolare centrale si distinguono in:
- Catetere-correlata (Catheter-Related Blood-Stream Infection, CRBSI) se l’infezione ematica è sicuramente correlata alla presenza di un catetere vascolare; cioè il microrganismo patogeno isolato nel sangue è identico a quello isolato nel catetere, confermando che la fonte del processo infettivo sistemico è lo stesso catetere.
- Catetere-associata (Catheter-Associated Blood-Stream Infection, CLABSI) se l’infezione ematica si verifica in quei pazienti portatori di un catetere vascolare; cioè il microrganismo isolato nel sangue è diverso da quello nel catetere, anche se in assenza di altri possibili focolai infettivi il catetere vascolare rimane l’unica causa plausibile di infezione.
Per colonizzazione di un catetere (Catheter Colonization) si intende, invece, la presenza di microrganismi, che si moltiplicano, però, senza provocare interazioni con l’organismo ospite (risposta immune e/o manifestazioni cliniche).
Tutti i cateteri vascolari vengono colonizzati dopo l’inserzione e la loro colonizzazione può avvenire per via:
- Extraluminale a causa di microrganismi provenienti dalla cute circostante e/o per via ematogena.
- Intraluminale a causa di microrganismi provenienti dai raccordi (rubinetti, rampe) delle vie infusionali e/o infusioni contaminate.
I microrganismi all’interno dell’organismo possono presentarsi liberi di circolare e quindi possono essere aggrediti più facilmente dagli antibiotici oppure possono formare colonie organizzate in strutture di sostegno polimeriche (biofilm), formate da mono- e polisaccaridi, proteine del tipo fibronectina ed acidi nucleici.
Si struttura, così, una specie di slime, che è simile ad una colla viscida, che favorisce l’adesione batterica. Dalla fase di adesione si passa alla fase di colonizzazione e a quella di maturazione, durante la quale la struttura del biofilm si deteriora e i microrganismi sono liberi di andare in circolo e causare il quadro settico.
Il biofilm forma una struttura a rete così fitta da creare una barriera alla penetrazione degli antibiotici e delle cellule del sistema immunitario, che non hanno così possibilità di agire.
Alcune infezioni si presentano con cicliche esacerbazioni e remissioni perché rifornite continuamente dal biofilm.
Il grave problema del biofilm è stato affrontato nei seguenti modi:
- Utilizzando alcune categorie di antibiotici (es. la Teicoplanina), che pare riescano a penetrare nella struttura.
- Prevenendo la formazione attraverso l’impianto di cateteri impregnati di ioni argento e/o medicati con antibiotici o clorexidina (coated CVC).
- I cateteri all’argento inibiscono la replicazione del DNA batterico da parte degli ioni di questo elemento; mostrando attività antibatterica ad ampio spettro, più accentuata per i Gram-, con il vantaggio della scarsa tossicità.
- I cateteri alla clorexidina ed argento-sulfadiazina (CSS) sono impregnati, nel caso di CSS di seconda generazione (CSS-2), sia esternamente con argento-sulfadiazina ma anche internamente con clorexidina in concentrazione tre volte maggiore rispetto a quelli di prima generazione (CSS-1). I due composti hanno attività sinergica in quanto l’azione della clorexidina di distruggere la membrana citoplasmatica batterica permetterebbe agli ioni argento di penetrare facilmente all’interno del batterio e legarsi al suo DNA; inibendo la replicazione del microrganismo.
- I cateteri medicati con antibiotici in genere comprendono quelli alla rifampicina-minociclina e quelli alla rifampicina-miconazolo; entrambi rivestiti sia internamente che esternamente, con discreta attività antimicrobica, ma con il rischio potenziale di selezionare ceppi batterici resistenti alla rifampicina.
- Evitando l’uso dell’eparina per il flush e lock del catetere, a meno che non consideriamo gli accessi per emodialisi o emaferesi, che vanno sempre eparinati.
Le prospettive future per ridurre la formazione del biofilm sono rappresentate dall’utilizzo di:
- Soluzioni anti-biofilm e antibatteriche, come l’etanolo, la taurolidina, il citrato > 10% e l’EDTA tetrasodico.
- Microfiltrazione (0,2 micron).
Nella definizione delle complicanze infettive secondarie all’utilizzo di dispositivi vascolari vanno annoverate, anche, le trombosi settiche, l’endocardite infettiva e altre infezioni a distanza dovute ad episodi di embolizzazione e il sospetto clinico sorge quando, nonostante una terapia antibiotica mirata, il paziente continui a manifestare febbre, secondo le linee-guida americane, dopo tre giorni dalla rimozione del device infetto.
Il bundle
Uno strumento che potrebbe aiutarci a ridurre o, addirittura, ad azzerare le complicanze, come quelle infettive, è rappresentato da un bundle; che è un insieme di semplici ma forti raccomandazioni, supportati da evidenza scientifica, facili da ricordare e mettere in pratica, ma che funziona solo se è applicato consapevolmente da tutti gli operatori, in ogni circostanza, rispettando tutti i suoi punti, utilizzandolo su tutti pazienti e controllandolo tramite una checklist (un elenco dettagliato delle fasi per verificare, in tempo reale, l’aderenza della procedura utilizzata al bundle stesso).
Uno dei più famosi bundle riguardante gli accessi vascolari è quello realizzato all’Institute for Healthcare Improvement della Johns Hopkins (Michigan) da Pronovost (2006).
Lo stesso utilizzando un bundle per l’impianto e una checklist ha ottenuto una riduzione drastica del tasso di infezioni correlate alla presenza del catetere vascolare.
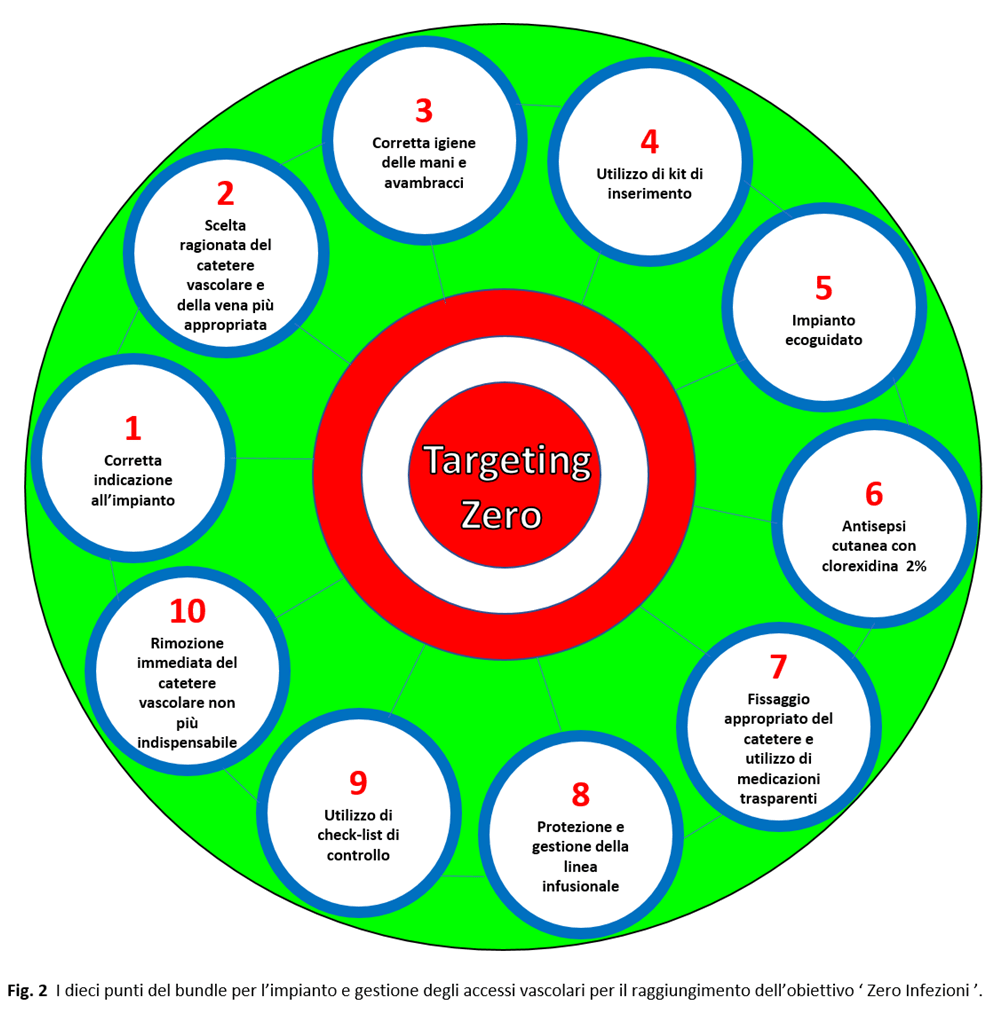
Considerando l’importanza di questo aspetto abbiamo pensato di creare un bundle, graficamente rappresentato in Fig. 2, riferendoci alle più aggiornate evidenze scientifiche, strutturandolo in dieci steps:
- Corretta indicazione ed effettiva necessità al posizionamento dell’accesso vascolare.
- Scelta ragionata del catetere vascolare e della vena più appropriata. La scelta ricade sulla valutazione delle condizioni e delle necessità cliniche del paziente; sulle caratteristiche delle soluzioni e dei farmaci da somministrare (osmolarità e pH), la via di somministrazione (periferica o centrale), durata della terapia e se il catetere servirà per un uso intra- o extra-ospedaliero. Questa scelta può essere facilitata da appositi algoritmi di tipo proattivo, che, sicuramente, favorirebbero:
- la riduzione delle complicanze,
- la sicurezza per il paziente,
- la miglior costo-efficacia clinica,
- la maggior efficienza aziendale e, quindi, un notevole risparmio economico.
Dopo aver scelto con l’algoritmo il catetere vascolare è necessario studiare ecograficamente le vene per poter individuare la vena più adatta per quel tipo di catetere.
I parametri da considerare e rispettare sono:
- Calibro della vena. Si valuterà il rapporto tra diametro della vena e il diametro del catetere che, idealmente, dovrà essere, come già detto, per ridurre le complicanze specialmente trombotiche, almeno 3:1.
- Sito di inserimento. Per il sito di impianto si raccomanda di evitare, possibilmente, le zone di flessione, la zona del collo e inguine, preferendo, nell’ordine, il terzo medio del braccio (area verde di Dawson), la zona sottoclaveare, la zona sopraclaveare e per ultimo collo e inguine.
Per quanto riguarda i PICC, i Midline e le cannule periferiche lunghe per il posizionamento al braccio, per evitare/ridurre, principalmente, le complicanze infettive e trombotiche, si potrebbe far riferimento al metodo ZIM (Zone Insertion Method) cioè ad uno schema, proposto da Dawson (2011), che suddivide il braccio, dalla piega del gomito al cavo ascellare, in 3 zone di uguale estensione; corrispondenti alla:
- Zona rossa nel terzo distale del braccio, quella vicino al gomito, che rappresenta la zona da evitare per l’impianto perché le vene sono di calibro più piccolo e i vari movimenti di flesso-estensione dell’avambraccio sul braccio possono influenzare la funzionalità del catetere.
- Zona gialla nel terzo prossimale all’ascella, in cui le vene hanno un calibro maggiore per cui sarà possibile impiantare cateteri con frenciaggio maggiore, riducendo così il rischio di complicanze trombotiche, ma aumentando quelle di tipo infettivo. Quindi se abbiamo necessità di impiantare nella zona gialla è bene tunnellizzare il PICC in modo da spostare il sito di emergenza nella zona verde.
- Zona verde posizionata nel terzo medio del braccio: è la zona ideale dove considerare il sito di emergenza (exit site) del catetere perché scevra da complicanze.
Se si è costretti all’impianto in vena femorale è preferibile tunnellizzare il catetere posizionando il sito di emergenza sulla coscia e non all’inguine.
- Profondità della vena. Per i PICC le vene da selezionare non dovrebbe essere situate ad una profondità maggiore di 2 cm dal piano cutaneo e questo per evitare malfunzionamenti a causa di una posizione viziata assunta dal catetere.
Il GAVeCeLT ha prodotto dei protocolli che possono guidare nella scelta corretta come il protocollo:
- RaPeVA (Rapid Peripheral Vein Assssment) per le vene del braccio.
- RaCeVA (Rapid Central Vein Assessment) per l’impianto centrale.
- RaSuVA (Rapid Superficial Vein Assessment) per lo studio delle vene superficiali nel neonato.
Si raccomanda fortemente l’utilizzo della tecnica ecoguidata e del microintroduttore, mediante tecnica di Seldinger modificata; che consiste nel pungere con un ago sottile da 21 G, a punta ecogena, attraverso cui far scorrere una guida metallica sottile a punta retta ma morbida (floppy straight tip) in nitinol (nichel-titanio).
3. Corretta igiene delle mani e avambracci utilizzando gel a base di clorexidina 4% e/o di alcol oppure acqua e sapone antimicrobico, prima e dopo l’impianto ma anche prima e dopo ogni manovra sul catetere. Ricordarsi che l’utilizzo di guanti sterili non esclude l’obbligo della detersione delle mani.
4. Utilizzo di kit di inserimento contenente le massime precauzioni di barriera per l’operatore (guanti e camice sterile, mascherina e berretto non sterili), per il paziente (ampio campo sterile in grado di coprire tutto il paziente) e per lo strumentario (ecografo, cavo e sonda ecografica) e di kit omnicomprensivi per la successiva gestione del sito di inserzione.
Importante, inoltre, per migliorare ulteriormente l’aderenza al bundle, avere a disposizione un carrello dedicato.
5. Utilizzo di impianto ecoguidato ovunque possibile sia per i cateteri centrali ad inserzione cervico-toracica (CICC) e femorale (FICC) che per quelli ad inserzione periferica nel braccio (PICC) e verifica della corretta posizione della punta; possibilmente, tramite ECG intracavitario (IC-ECG), che eviterebbe la fluoroscopia di controllo.
Sono da proscrivere:
- L’approccio alla cieca (blind) e l’isolamento chirurgico di qualsiasi tipo di vena, per un maggior rischio di infezione e di fenomeni tromboflebitici, maggior traumatismo tissutale e non costo-efficacia.
- L’utilizzo di antibiotici come profilassi delle infezioni da catetere. Non esistono evidenze che questa pratica riduca il tasso di infezioni, ma, al contrario, potrebbe provocare antibiotico-resistenza, aumentare il rischio di effetti collaterali.
In caso di posizionamento, in ambito neonatale, di catetere venoso periferico e di epicutaneo-cavale (ECC) è preferibile, se si ha difficoltà con l’ecografia, utilizzare, se disponibile, la tecnica NIR-guidata.
6. Antisepsi cutanea con clorexidina gluconato, meglio in concentrazione al 2% e comunque > 0,5% in alcol isopropilico (IPA) al 70% in alcuni casi in soluzione acquosa (1ª scelta) effettuando un accurato scrub della zona (eseguito 2 volte), mediante applicatore monodose, monouso, preferibilmente colorato rosso e sterile prima dell’impianto e al momento del cambio della medicazione, con tecnica asettica e ‘no touch’ per 30 secondi lasciando asciugare per altri 30 secondi. Le soluzioni di iodopovidone al 10% (2ª scelta) sono meno efficaci e andrebbero utilizzate solo per pazienti allergici alla clorexidina.
I tempi di contatto, cioè di asciugatura dell’antisettico sulla cute, per ottenere una efficace antisepsi, sono i seguenti:
- Clorexidina in alcol 30 sec.
- Clorexidina in soluzione acquosa 2 minuti.
- Iodopovidone 2 minuti.
La clorexidina rispetto alllo iodopovidone presenta diversi vantaggi come un più ampio spettro d’azione, maggior durata dell’effetto antisettico ed una efficace azione antifungina. Inoltre lo iodopovidone viene inattivato dalla presenza di liquidi biologici come sangue, siero e altre secrezioni. L’alcol isopropilico è da preferire all’alcol etilico per la sua minore aggressività sulla cute e sui cateteri in silicone e poliuretano.
Nel bambino < 2 mesi non esiste un proprio divieto all’utilizzo della clorexidina, ma solo un rilevante invito all’utilizzo con cautela minimizzando le reazioni, senza rinunciare ai notevoli vantaggi della clorexidina, con alcune precauzioni, come uso della minima quantità possibile di antisettico senza strofinare la cute, utilizzo di applicatore monodose sterile, rimozione di tutta la clorexidina in eccesso, utilizzo di soluzione fisiologica dopo l’applicazione e asciugatura della clorexidina.
Nel neonato bisogna evitare di usare la tintura di iodio a causa dei potenziali effetti tossici sulla ghiandola tiroidea.
7. Fissaggio appropriato del catetere e utilizzo di medicazioni trasparenti semipermeabili.
Per evitare la dislocazione del catetere si utilizzano dispositivi particolari che si chiamano Sutureless Devices (SD) o Engineered Stabilization Device (ESD), che hanno sostituito, già da tanti anni, il fissaggio tramite punti di sutura.
I punti di sutura creavano, con il tempo, decubiti e veri e propri fenomeni suppurativi a differenza dei sistemi di fissaggio attuali, che evitano queste complicanze.
I SD o ESD possono essere integrati alla medicazione o presenti come sistemi ad adesività cutanea (SAC) oppure come sistemi ad ancoraggio sottocutaneo tramite due alette in nitinol (SAS).
I SAS si possono utilizzare se la durata prevista del catetere centrale è > 15 giorni, presentando i seguenti vantaggi:
- Le alette in nitinol vengono poste all’interno del foro cutaneo di entrata del catetere, consentendo un ottimo fissaggio sottocutaneo.
- Facilità di sfilare il catetere se risulta posizionato troppo in profondità nella vena.
- Medicazione più agevole, perché il fissaggio resta sempre fermo sull’exit-site; a differenza dei sistemi ad adesività cutanea che sono obbligati a seguire le alette del catetere.
- Evitano problemi legati ai fissaggi adesivi in pazienti allergici o intolleranti o problemi di irritazioni e lesioni cutanee.
- Non aderisce alla cute e non si deve sostituire periodicamente, ad ogni cambio di medicazione, ma rimane in sede fino alla rimozione del catetere.
- Diminuzioni dei costi di un eventuale riposizionamento del catetere e di quelli riguardanti l’interruzione della terapia.
- Nel bambino, considerando la difficile rimozione accidentale del catetere con questo sistema, si può impiantare un PICC in vena centrale e tunnellizzarlo con maggior sicurezza e maggior durata.
Le medicazioni consigliate sono quelle trasparenti semipermeabili in film adesivo di poliuretano, ipoallergenico e privo di lattice, impermeabile ai liquidi, batteri e virus che consentono di ispezionare l’exit-site, possibilmente con bordo, che le rende più stabili, dotate di alta traspirabilità, caratteristica che consente una ossigenazione e una evaporazione ottimali sotto la medicazione.
La traspirabilità è definita dalla Moisture Vapour Transmission Rate (MVTR) o Water Vapor Transmission Rate (WVTR), proprietà che indica il passaggio del vapore acqueo, nell’unità di tempo, attraverso una sostanza, che in questo caso è rappresentata dalla medicazione trasparente.
Una MVTR elevata significa ridurre l’umidità e mantenere asciutta la cute sotto la medicazione, ottenere un fissaggio più sicuro e una minore colonizzazione batterica, con riduzione del rischio di infezioni (un ambiente caldo umido, invece, favorirebbe la proliferazione di microrganismi).
Una buona medicazione, quindi, non deve essere solo semipermeabile trasparente ma garantire, anche, una buona traspirabilità. Questo tipo di medicazione può essere sostituita ogni 7 giorni o prima se visibilmente sporca, staccata o bagnata.
Un particolare dispositivo da associare alla medicazione, come barriera nei confronti della migrazione extraluminare dei microrganismi, è il feltrino in poliuretano idrofilo assorbente a rilascio continuo di clorexidina da cambiare insieme alla medicazione (i feltrini non sono raccomandati nei bambini < 2 mesi). Sono in commercio, anche, le medicazioni trasparenti munite di un cuscinetto di gel (pad gel) a lento rilascio di clorexidina al 2% (anche queste non sono raccomandate nei bambini < 2 mesi).
La medicazione garzata o premedicata va utilizzata, per la sua maggiore capacità assorbente, in caso di sudorazione profusa, presenza di secrezioni, lesioni cutanee o sanguinamento locale, specie nelle prime 24 ore dopo l’impianto, da cambiare ogni 48 ore o secondo necessità.
La medicazione bagnata, sporca o staccata va sostituita immediatamente.
Il sito di ingresso del catetere può essere sigillato, evitando di posizionare il feltrino, con colla sterile, in confezione monodose, al cianoacrilato (istoacrilica), non tossica, che oltre a previene il sanguinamento costituisce, nel contempo, una valida barriera antimicrobica. L’associazione sutureless, colla istoacrilica e membrana trasparente garantisce la massima stabilizzazione e protezione del sito di emergenza del catetere. Considerare, comunque, eventuali lesioni cutanee associate ad adesivi medici (MARSI), secondarie all’uso dispositivi di stabilizzazione ad adesività cutanea.
Ribadiamo, inoltre, con forza che il catetere, l’exit-site e l’ago del Port (di Huber) non andranno, mai, manipolati a mani nude o con guanti non sterili, ricordandosi che le mani Toccano, Trasportano e Trasmettono (Regola delle ‘3 T’).
8. Protezione e gestione della linea infusionale.
- Utilizzare cappucci a valvola a pressione neutra (NFC-needlefree connectors) per la protezione delle porte di accesso del catetere (hub); che sono sistemi di chiusura dei cateteri con modalità di connessione senza ago e dotati di raccordo luer-lock. Essi riducono i rischi legati alle punture accidentali da parte dell’operatore, i rischi di contaminazione e di occlusione del catetere (evitano il ‘backflow’ alla deconnessione del sistema).
- Disinfettare gli hub strofinandoli (scrubbing) con garza contenente soluzione alcolica alla clorexidina 2% o alcol isopropilico 70% per 30 secondi e lasciando asciugare per 30 secondi (disinfezione attiva). Oppure applicando sulla porta un port protectors, cioè un tappino luer lock che all’interno contiene una spugnetta imbevuta di alcol isopropilico al 70% (disinfezione passiva).
- Lavare e/o chiudere (flush e lock) la via infusionale con soluzione fisiologica 0,9%, preferibilmente con siringhe pre-riempite sterili, per la prevenzione delle infezioni e il risparmio sui tempi tecnici di preparazione, con tecnica pulsata ‘start and stop’. Tale lavaggio deve essere eseguito all’apertura del sistema ma anche prima e dopo ogni infusione, per evitare la miscelazione di farmaci o soluzioni incompatibili e/o per pulire il lume da sangue o accumuli di fibrina. Nell’adulto si raccomanda di lavare il sistema con siringa da 10 ml riempita con fisiologica (le siringhe da 10 ml esercitano pressioni meno elevate rispetto a quelle da 5 ml), attraverso un lavaggio attivo, cioè spingendo a mano lo stantuffo con scatti di 2-3 ml per volta. In alcune condizioni, come dopo un prelievo, infusione di sangue e derivati, dopo nutrizione parentarale con lipidi e dopo iniezione di mezzo di contrasto è importante un lavaggio con 20 ml di soluzione fisiologica. Insieme al lavaggio (flush) è bene chiudere (lock) ogni via del catetere, a fine uso, con soluzione fisiologica. Nel neonato si utilizzano quantità di lavaggio inferiori (1-2 ml o almeno 3-6 volte il volume dello spazio morto del catetere). Quando si effettua il flush, prevenire il reflusso di sangue lasciando una piccola quantità di soluzione fisiologica (ad es. 0.5-1 mL) all’interno della siringa. Il flush non deve essere mai effettuato con acqua distillata sterile.
La chiusura e il lavaggio con eparina del catetere sembrerebbero favorire, secondo alcuni studi, la crescita batterica e la formazione di biofilm e, inoltre, non vi è alcuna evidenza che sia più efficace rispetto alla chiusura e al lavaggio con fisiologica, ad eccezione degli accessi per emodialisi o emaferesi, che vanno sempre eparinati.
La soluzione eparinata non ha proprietà trombolitica, per cui in caso di ostruzione del catetere da coaguli possiamo tentare la disostruzione con fisiologica e in caso di fallimento con urokinasi.
Se si sospetta, invece, una ostruzione da farmaci o mezzo di contrasto si può utilizzare sodio bicarbonato ed etanolo in caso di ostruzione da lipidi.
- Prestare attenzione alla integrità, conservazione, scadenza e preparazione delle soluzioni da infondere, dei deflussori e raccordi da utilizzare evitando, così, la contaminazione endoluminale e alla sostituzione in modo appropriato delle linee infusionali.
Le somministrazioni continue, tipicamente in ambito ospedaliero, non devono essere sostituite più frequentemente di 96 ore, salvo diversa indicazione del produttore o in caso si verifichi una deconnessione o bisogna sostituire il catetere.
Quando si infonde una emotrasfusione, filtri e set di somministrazione vanno sostituiti al termine di ogni unità di sangue o comunque ogni 4 ore.
Le linee infusionali vanno sostituite ogni 24 ore in caso di somministrare di nutrizione parenterale contenente lipidi o altre soluzioni lipidiche.
Le sacche nutrizionali all-in-one e le emulsioni lipidiche devono essere infusi mediante set di somministrazione privi di dietilesilftalato (DEHP), che è una sostanza lipofilica. I lipidi della infusione lo estraggono dal polivinilcloruro che può essere un costituente dei set di somministrazione e dei contenitori. Il DEHP è tossico, e diversi studi ne hanno dimostrato livelli significativi nelle soluzioni lipidiche, con conseguente rischio soprattutto nei neonati e nei bambini.
- Minimizzare l’utilizzo di dispositivi aggiunti (add-on devices) lungo la linea infusionale, rappresentando ogni dispositivo una ulteriore fonte di contaminazione, deconnessione ed errori di utilizzo.
- Usare preferibilmente linee infusionali in cui i vari componenti siano tutti preassemblati.
- Evitare il più possibile di disconnettere il catetere dalla linea principale.
- Limitare il più possibile l’uso di rubinetti per evitare un aumento del rischio di infezioni; ma preferire i dispositivi dotati di un connettore senza ago integrato.
- Non utilizzare i cateteri periferici per terapie vescicanti continue, per nutrizione parenterale, per terapie infusionali con una osmolarità superiore a 600 mOsm/L e pH <5 o >9.
9. Utilizzo di check-list di controllo per valutare l’adesione al bundle delle misure attuate per la prevenzione delle infezioni legate all’impianto e gestione del catetere.
10. Rivalutazione quotidiana della reale utilità del catetere.
Il catetere va rimosso quando non più necessario e in caso di infezione batteriemica catetere- correlata nei seguenti casi:
- Sepsi grave.
- Tromboflebite settica.
- Endocardite.
- Infezione batteriemica da Staphylococcus aureus, Pseudomonas aeruginosa, funghi o micobatteri.
- Batteriemia persistente dopo 72 ore di terapia a cui il microrganismo è sensibile.
Nessun catetere venoso andrebbe rimosso basandosi esclusivamente sulla comparsa di febbre.
La valutazione del dispositivo, del sito d’inserzione e del vaso incannulato deve essere eseguita più volte al giorno in base all’utilizzo del presidio e dei farmaci infusi al paziente. Queste osservazioni possono essere ottimizzate attraverso l’utilizzo di scale di valutazione, come la Visual Infusion Phlebitis Score(VIP), che è uno strumento validato, anche nella sua traduzione in lingua italiana, e affidabile per determinare adeguatamente il rischio e l’eventuale presenza di flogosi associata alla presenza di un catetere, suggerendo la rimozione e/o la sostituzione dello stesso.
La letteratura suggerisce, per la validità, affidabilità e fattibilità, anche la Phlebitis Scale.
La creazione del Bundle: rappresentazione grafica
Considerazioni conclusive
La creazione del bundle, sia per l’impianto che per la gestione dei cateteri, semplificando la standardizzazione della procedura e la verifica, attraverso la check-list, della sua corretta adozione rappresentano elementi fondamentali per la prevenzione delle infezioni e delle complicanze da catetere vascolare, ma dobbiamo anche considerare altri aspetti, non meno importanti, come la:
- Formazione e addestramento continuo degli impiantatori e degli infermieri addetti alla gestione del catetere, con un programma che preveda un audit finale e dei refresh a distanza programmata.
- Creazione di un programma aziendale che preveda la sorveglianza, il risk management e l’utilizzo di definizioni chiare e univoche.
- Possibilità da parte di ogni Unità Operativa di identificare un referente medico e uno infermieristico per questo aspetto così importante.
- Costituzione di un team medico-infermieristico motivato, formato e, per quanto possibile, dedicato al posizionamento degli accessi vascolari (CVC-PICC Team). La competenza, il ‘know how’ si acquisisce frequentando congressi e corsi di formazione, in accordo con le raccomandazioni delle Consensus WoCoVA (World Congress on Vascular Access) e GIPE (Gruppo Italiano PICC Exper) sul posizionamento ecoguidato degli accessi vascolari, e frequentando, se è presente, il CVC-PICC Team del proprio ospedale.
- Consapevolezza di voler realizzare un cambio culturale, alla cui base devono essere presenti le migliori evidenze scientifiche (EBN), cioè la metodologia che valuti i migliori risultati disponibili in letteratura nel preciso momento in cui si effettua la ricerca scientifica.
- Non va dimenticata la fondamentale importanza del controllo del dolore, specialmente nel neonato e nel bambino, perché una puntura produce stress, dolore e instabilità delle condizioni generali con variazioni della saturazione dell’ossigeno, aumento del flusso e pressione cerebrali, tachicardia e ipertensione sistemica. E’ indispensabile ridurre e controllare queste situazioni di stress e dolore adottando sinergicamente strategie, presidi specifici, anestetici locali, sedazione e scale di valutazione.
Questi rappresentano punti cardini per ottenere il vantaggio/sicurezza/soddisfazione del paziente, che è al centro dell’assistenza; ma anche la sicurezza e produttività dell’operatore e il bene dell’azienda sanitaria, grazie alla scelta appropriata del catetere, alla tecnica di impianto, alla valutazione del luogo di impianto (bedside o ambiente dedicato) e della figura professionale dedicata all’impianto o, meglio, di un “PICC-Team” aziendale, che si traducono in efficienza della procedura e in miglioramento della costo-efficacia.
Il miglioramento della procedura, inoltre, nel pieno rispetto di quanto proposto dell’evidenza scientifica, permetterebbe di risparmiare il prezioso patrimonio venoso, specialmente in alcuni pazienti (neonato, pz oncologico, ecc…), riducendo il rischio di trovarsi un paziente ‘senza vene’, definito DIVA (Difficult Vascular Access Patient).
Bibliografia
Linee guida consultate:
- CDC (2011).
- EPIC3 (2014).
- SHEA-IDSA (2014).
- INS (2016).
- SIAARTI (2018).
Articoli:
- Barton, A., Danek, G., Johns, P. & Coons, M. (1998) ‘Improving patient outcome through CQI: Vascular access planning’. Journal of Nursing Care Quality, vol. 13 no. 2, pp. 77-85.
- Dentico, D. & Ferri, F. (2019) ‘Prevenzione delle infezioni da dispositivi vascolari, un bundle Evidence-Based’. OPI Bari, Filodiretto, vol. 3, no. 5/6, pp. 23-25.
- Frykholm, P., Pikwer, A., Hammarskjold, F. et al. (2014) ‘Clinical guidelines on central venous catheterisation’ Acta Anaesthesiol Scand, no. 58, pp. 508-24.
- Perucca, R. (2010) Peripheral venous access devices. eds. Infusion Nursing: An EvidenceBased Approach. 3rd Edition. St Louis, MO: Saunders/Elsevier, pp. 456-479.
- Pronovost, P., Needham, D., Berenholtz, S., Sinopoli, D., Chu, H., Cosgrove, S., Sexton, B., Hyzy, R., Welsh, R., Roth, G., Bander, J., Kepros, J., Goeschel, C. (2006) ‘An intervention to decrease catheter-related bloodstream infections in the ICU’. N Engl J Med. Vol. 355, no. 26, pp. 2725-32.
- Wallis, M,C,, McGrail, M., Webster, J., (2014) ‘Risk factors for peripheral intravenous catheter failure: a multivariate analysis of data from an RCT’. Infect Control Hosp Epidemiol., vol. 35, no. 1, pp. 63-68.
- Tarricone, R. et al. (2010) ‘Hospital costs of centralline-associated bloodstream infections and cost-effectiveness of closed vsopen infusion containers. The case of Intensive Care Units in Italy’. BioMed Central, doi:10.1186/1478-7547-8-8.
Testi di riferimento
- Pittiruti, M., & Capozzoli, G. (2016) ‘Manuale pratico dell’accesso venoso’. 1st Edition Roma: Antonio Delfino.
- Pittiruti, M., & Scoppettuolo, G. (2016) ‘Manuale GAVeCeLT dei PICC e dei Midline’. 1st Edition Milano: Edra S.p.A.
- Vigneri, M., (2018) ‘Gli accessi vascolari’. 1st Edition Torino: Edizioni Minerva Medica
Sitografia
- Gavecelt – Impianto Sicuro del PICC/SIP (Safe Insertion of PICC) 2017 e PIDAV (Prevenzione delle Infezioni da Dispositivi di Accesso Venoso), visitato il 10 luglio (2020) <https://www.google.com/search?client=firefox-b-d&q=Gavecelt>
- Roberto Verna, R. et al. (2017) ‘Recepimento ed applicabilità sul territorio Italiano delle principali linee guida e raccomandazioni internazionali sugli accessi venosi’, visitato il 01 luglio (2020) <https://www.osservatoriosanitaesalute.org/wp/wp-content/uploads/2017/12/rev-09-ACCESSI-VENOSI.pdf>








Lascia un commento