L’Aneurisma del Setto Interatriale è una anomalia cardiaca che si diagnostica mediante esame ecografico (o autoptico) ed è una patologia emboligena.
L’Aneurisma del Setto Interatriale può, secondo diversi studi eseguiti, essere causa di ictus cerebrali andando ad occludere vasi afferenti al cervello, infatti secondo la classificazione TOAST il 15-20% degli ictus sono di origine cardiaca.
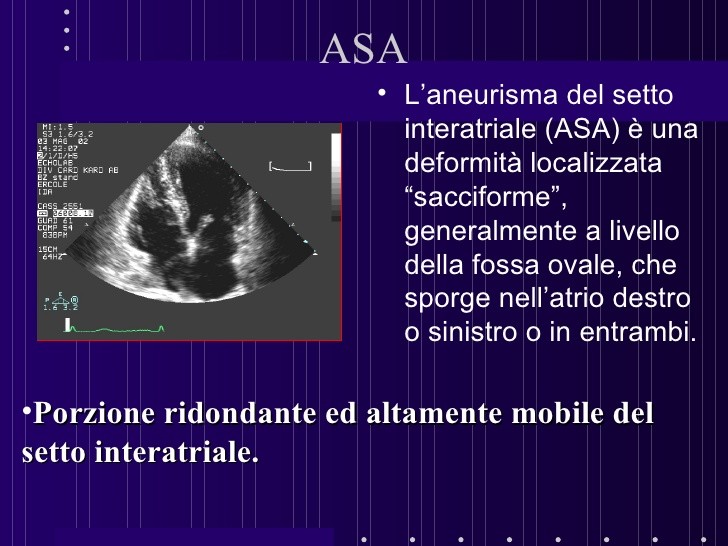
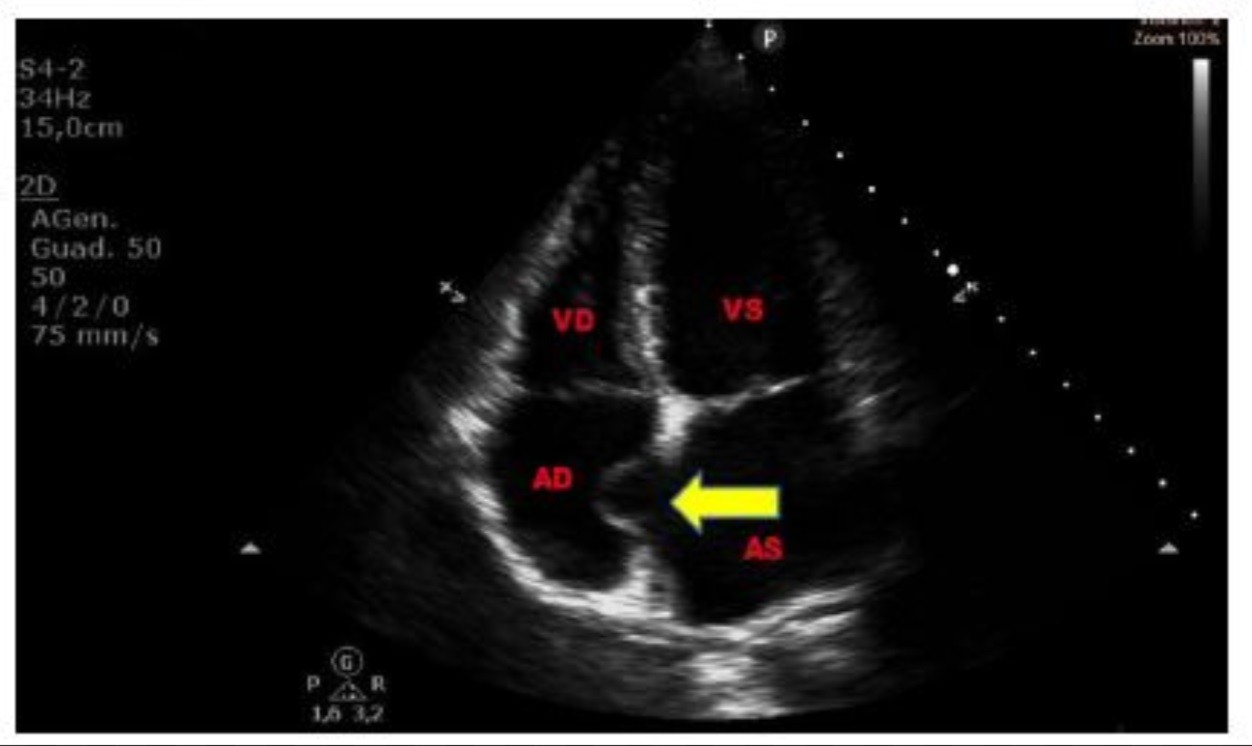
Morfologicamente, l’ASA è descritto come una parete assottigliata costituita da tessuto connettivo delimitato su entrambe le superfici da cellule endoteliali. Gli studi autoptici hanno dimostrato che, istologicamente, un setto aneurismatico è più sottile (0.4-0.8 mm) di un setto normale (2 mm),
I criteri diagnostici, grazie ad esame ecografico, sono i seguenti:
- protrusione o “bulging” del setto interatriale o di una parte di esso > 15 mm, oltre la linea mediana che identifica il piano del setto;
- escursione fasica del setto interatriale, durante il ciclo respiratorio, con una somma globale dell’escursione > 15 mm;
- base della porzione aneurismatica > 15 mm.
In seguito tali criteri, sono stati, in parte, modificati ad opera di altri autori che hanno considerato sufficiente per la diagnosi di ASA un’escursione del setto > 10 mm all’interno dell’atrio destro o sinistro, oppure, una somma totale delle escursioni bidirezionali > 10 mm con una base ≥ 15 mm.
Con questa nuova definizione il numero di aneurismi evidenziati con l’ecocardio aumentano numericamente, rientrando nei termini della definizione.
Il legame tra ischemia cerebrale e ASA è stato, per la prima volta, indicato nel ’97.
Una metanalisi eseguita su ampia scala, di Overell JR pubblicata su Neurology nel 2002 ha confermato, che sia l’ASA che il PFO sono significativamente associati allo stroke nei pazienti giovani (età< 55 anni).
L’evidenza che nei giovani l’ASA ed il PFO sono associati all’ischemia cerebrale non può più essere considerata accidentale.
I tradizionali fattori di rischio sembrano avere un ruolo molto più importante negli adulti (età> 55 anni) e negli anziani, nei quali, invece, il ruolo dell’ASA e del PFO non è tutt’oggi, confermato.
In uno studio multicentrico prospettico pubblicato nel 2001 da Mas JL et al sul N Engl J Med è stato calcolato il rischio relativo e assoluto di eventi stroke associati a PFo, ASA o entrambi nei giovani affetti da stroke criptogenetico.
La correlazione è risultata del 15,2 % nei pazienti con ASA e PFO mentre non ci sono risultati per l’ASA isolato.
L’ASA isolato quindi non sembra essere potenzialmente emboligeno ma la sua causalità nel determinare stroke criptogenetico è associata ad altre anomalie quali PFO, DIA, Prolasso valvolare mitralico, Pervietà del dotto di Botallo, Aritmie sopraventricolari.
L’associazione più frequentemente riscontrata è ASA + PFO, la stretta relazione tra le due anomalie ha fatto sì che il meccanismo dell’embolia paradossa via PFO fosse considerato per lungo tempo il meccanismo attraverso il quale l’ASA determini lo stroke, tuttavia la diagnosi di ASA+PFO non è la prova assoluta che si sia verificato un fenomeno di embolia paradossa.
In questo caso sono necessari ulteriori riscontri come la presenza di materiale trombotico per una diagnosi di certezza o trombi nel circolo venoso per una diagnosi di presunzione.
Pertanto se si considera l’embolia paradossa come meccanismo patogenetico l’ASA isolato non può essere considerato embolico ma solo fattore di rischio associato che aumenterebbe la probabilità di shunt dx-sx favorendo, data la mobilità, il passaggio di piccoli trombi.
Altre anomalie associate all’ASA sono: Prolasso della mitrale, Presenza di residui embrionali.
Nel caso di associazione di ASA e prolasso della mitrale è stato ipotizzato un deficit del connettivo, tuttavia poiché nei pazienti con stroke la prevalenza del prolasso mitralico presenta una variabilità tra il 2 e il 40% il suo ruolo come fattore determinante è ancora controverso.
Per quanto riguarda l’associazione di ASA e valvola di Eustachio (residuo embrionale presente nella regione di sbocco della vena cava inferiore in atrio destro), sembrerebbe che la valvola di Eustachio determini embolia paradossa direzionando il flusso ematico verso la fossa ovale costituendo quindi fattore di rischio di stroke in caso di presenza di PFO.
A tal conclusione ci ha portato lo studio PICSS (Patient Foramen Ovale in Cryptogenetic Stroke Studi).
Successivamente nel 2004 Schuchlenzsul pubblicava su J Am. Soc. Echocardiog che vi era una maggiore predisposizione all’embolia paradossa nei pazienti con ASA e/o PFO e persistenza della valvola di Eustachio rispetto ai pazienti che non presentavano questo residuo embrionale.
Da quanto qui esposto, malgrado gli studi eseguiti, esistono tante perplessità nel ruolo dell’ASA, come protagonista unico o associato, nella patogenesi dell’embolia paradossa e quindi essere causa di stroke, pertanto si sono cercate altre ipotesi etiopatogenetiche per spiegare il ruolo dell’ASA nel determinismo stroke.
Attualmente le conoscenze a disposizione non consentono di affermare che le anomalie del setto interatriale, da sole, possano determinare la formazione di emboli e quindi la comparsa di ictus.
Infatti sono molto più frequenti le associazioni tra ASA, oltre che al PFO, con varie anomalie atriali (difetti interatriali, aritmie atriali, prolasso valvolare mitralico,etc.) sopratutto nei soggetti con età inferiore ai 55 anni.
Ciascuna di queste anomalie potrebbe essere una potenziale fonte di emboli. Quindi non è affatto facile determinare quanto l’ASA isolato possa essere una sorgente indipendente di emboli.
Anche quando sono stati ipotizzati altri meccanismi patogenetici (ASA cribroso, associazione ASA-fibrillazione atriale, trombi nella sacca aneurismatica, embolia paradossa tramite PFO, fattori genetici incidenti sulla coagulazione) non è stato possibile dimostrare appieno queste ipotesi.
Pertanto sono necessari numerosi ulteriori studi per poter confermare se l’ASA (isolato e non), sia una causa diretta di ischemie cerebrali o una concausa o soltanto un ulteriore fattore di rischio.
CALABRESE Michele
Fonte









Lascia un commento